1. Фосфорная кислота может быть использована, чтобы получить:
1) 3 разных буферных раствора
2) только один буфер НРО42-, Н2РО4-
3) не дает буферных систем
4) только в смеси с уксусной и борной кислотами
2. Кислотно–основное состояние организма связано главным образом с:
1) бикарбонатной буферной системой
2) фосфатной буферной системой
3) белковой буферной системой
4) аммиачной буферной системой
3. Экстренная мера при ацидозе:
1) Na2SO4
2) NaHCO3
3) NH4CH3COO
4) NH4CI
4. Зона действия буферной системы – это:
1) рН > pKд слабого электролита
2) рН < pKд слабого электролита
3) рН = pKд ± 1
4) рН = pKд слабого электролита
5. К фосфатной буферной системе прибавили щелочь:
1) концентрация H2PO4- уменьшается, концентрация HPO42- увеличивается
2) концентрация H2PO4- увеличивается, концентрация HPO42- уменьшается
3) концентрация компонентов увеличиваются одинаково
4) обе концентрации не меняются
6. Смешали 100мл 0,1н CH3COOH (рК = 4,76) и 100мл 0,1н CH3COONa рН раствора:
1) 5,36
2) 4,16
3) 4,76
4) 5,10
7. Буферное действие белков связано:
1) с их амфотерными свойствами
2) с образованием катионов
3) с образованием анионов
4) с образованием биполярного иона
8. Какой вид имеет уравнение Гендерсона – Гассельбаха для бикарбонатной буферной системы в крови человека:
1) рН = рКа + lg 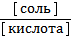
2) рН = 6,11 + lg 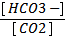
3) рН = 14 - рКосн - lg 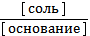
4) рОН = рКосн - lg 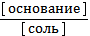
9. Щелочной резерв крови – это:
1) число мл СО2 в 100 мл крови
2) число мл NaOH при титровании
3) ацидоз
4) алкалоз
10. В каком объемном отношении смешали 0,1н растворы NH4CI и NH4OH (рК=4,76), если рН буферного раствора равно 9,24:
1) 1:2
2) 2:1
3) 1:1
4) 2:3
11. При физиологическом значении рН=7,36 соотношение [ HPO42- ] / [ H2PO4- ] равно:
1) 20:1
2) 10:1
3) 16:3
4) 4:1
12. При добавлении HCI к буферной системе NH4CI / NH4OH
1) конц. NH4CI уменьшается, конц. NH4OH увеличивается
2) конц. NH4CI увеличивается, конц. NH4OH уменьшается
3) увеличиваются обе конц.
4) конц. компонентов не меняются
13. Найдите верную фразу:
1) буферная емкость не зависит от количества добавленного сильного электролита
2) максимальная буферная емкость при рН = рК слабого компонента системы
3) буферная емкость меняется только при добавлении сильной кислоты
4) буферная емкость – величина постоянная
14. При физиологическом значении рН=7,36 соотношение [ HCO3- ] / [ CO2 ] равно:
1) 20:1
2) 15:3
3) 10,7:1
4) 4:1
15. В плазме крови (рН=7,36 – 7,42) отсутствует:
1) белковый буфер
2) аммиачный буфер
3) фосфатный буфер
4) бикарбонатный буфер
16. Найдите гемоглобиновую буферную систему:
1) HCOO-, HCOOH
2) HCO3-, H2CO3
3) Hb-, HHb, HbO2-, HHbO2
4) CH3COO-, CH3COOH
17. рН буферного раствора при добавлении сильных кислот, щелочей:
1) приблизительно сохраняется
2) резко возрастает
3) резко уменьшается
4) сначала увеличивается, а потом уменьшается
18. Общая, активная, потенциальная кислотность (щелочность) характерна для:
1) сильных электролитов
2) слабых электролитов
3) гидролизующихся солей
4) неэлектролитов
| Вариант 5 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
 2015-06-14
2015-06-14 1621
1621
