Поверхностные явления в адгезированных полимерных системах
Для описания поверхностных явлений в адгезированных полимерных системах требуется знание не только характеристики массы или объема составляющих фаз (твердой (Т), жидкой (Ж) и газообразной (Г)), но и свойств пограничной области между ними, т.е. границы раздела фаз. Таким образом наука о поверхностных явлениях включает в себя не только физику, но и химию поверхности.
Поверхностная энергия раздела фаз
Структура поверхностного слоя отличается от структуры внутренних слоев по двум причинам. Первая, атомы и молекулы, расположенные на поверхности, имеют избыточную энергию по сравнению с частицами, расположенными внутри материала. Вторая, поверхностный слой постоянно взаимодействует с окружающей средой, благодаря чему он претерпевает постоянные изменения.
Появление избыточной энергии на поверхности раздела фаз связано с некомпенсированостью межатомного, межмолекулярного взаимодействия в твердых и жидких поверхностях.
Силы, определяющие избыточную поверхностную энергию:
1) Ориентационные силы, диполь-дипольное притяжение. (силы Дебая).
Осуществляется между молекулами, являющимися постоянными диполями (для полярных молекул). Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.

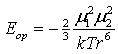
где μ1 и μ2 – дипольные моменты взаимодействующих молекул;
k – константа Больцмана (k = 1,38066·1023 Дж/К);
Т – температура;
r – расстояние между молекулами.
2) Силы взаимодействия диполь - индуцированный диполь (Кеезомовские силы).
Силы возникают при взаимодействии между постоянным и наведенным (индуцированным) диполем. Дипольная молекула может влиять на неполярные молекулы и вызывать некоторое смещение электронов и ядер окружающих молекул (поляризацию), при этом возникает наведенный диполь. Постоянный и наведенный диполи взаимно притягиваются. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
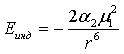
где а2 – величина поляризуемости неполярной молекулы.
3) Кулоновское взаимодействие:
Взаимодействие неподвижных электрических зарядов называют электростатическим или кулоновским взаимодействием. Кулоновские силы можно изобразить графически (рис. 14, 15).
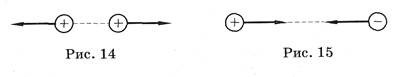
Кулоновская сила направлена вдоль прямой, соединяющей заряженные тела. Она является силой притяжения при разных знаках зарядов и силой отталкивания при одинаковых знаках зарядов.
4) Силы дисперсионного взаимодействия.
Дисперсионные силы (Лондоновские силы) обусловлены движением электронов в молекулах. Систему «электрон – ядро» можно рассматривать как диполь, отрицательный полюс которого (электрон) быстро перемещается. В молекулах, находящихся на небольшом расстоянии друг от друга, движение электронов становится в известной мере согласованным, и диполи часто оказываются обращенными друг к другу противоположно заряженными полюсами. Вследствие этого возникает притяжение молекул. Энергия дисперсионного взаимодействия тем больше, чем слабее связь электронов с ядрами:
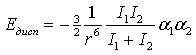
где а1 и а2 - величины поляризуемости двух взаимодействующих молекул;
I1 и I2 – ионизационные потенциалы молекул.
Лондоновские силы, чаще называемые дисперсионными силами, являются основными ответственными за когезию жидкостей (как полярных, так и неполярных), полимеров и различных твердых тел, а также за величину адгезионного взаимодействия, которое между ними возникает.
5) Особое место среди межмолекулярных сил занимают водородные связи. Они прочнее сил Ван-дер-Ваальса и существенно влияют на свойства полимеров. Водородная связь возникает между атомом водорода, связанного ковалентной связью, и другим атомом, имеющим большую электроотрицательность и хотя бы одну неподеленную пару электронов (фтор, кислород, азот, хлор, сера). Другими словами, это связь между двумя электроотрицательными атомами через водород.
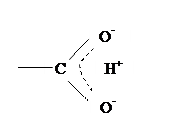
Водородные связи возможны, если в макромолекуле содержатся гидроксильные, карбоксильные, амидные и другие подобные группировки. Энергия водородной связи невелика (20–35 кДж/моль). Она меньше величины валентных сил, но больше сил Ван-дер-Ваальса.
Энергия индукционных взаимодействий Еинд. мала и не превышает 5% от суммарного эффекта; вклад энергии дисперсионных взаимодействий Едисп. является наиболее значительным (до 80–90% от суммарного эффекта), однако для молекул с большими дипольными моментами энергия ориентационных взаимодействий Еор может приближаться к дисперсионной или даже превышать ее.
В настоящее время суммарное взаимодействие рассматривают как вектор в трехмерном пространстве, где по осям координат отложены силы взаимодействия полярных, лондоновских и водородных.
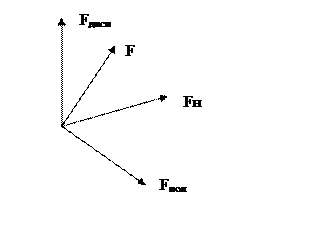
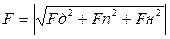
F – суммарное взаимодействте.
Энергетическое состояние поверхности характеризуется удельной поверхностной энергией, которая численно равна поверхностному натяжению.
σ [Дж/м2]
Физический смысл поверхностной энергии:
- это энергия, необходимая для увеличения поверхности раздела фаз на единицу площади.
Поверхностное натяжение имеет двойной физический смысл. Энергетическое (термодинамическое) определение: поверхностное натяжение - это удельная работа увеличения поверхности при её растяжении при условии постоянства температуры. Силовое (механическое) определение: поверхностное натяжение - это сила, действующая на единицу длины линии, которая ограничивает поверхность жидкости.
Энергетическое состояние любой системы и возможность протекания тех или иных процессов описывается термодинамическими потенциалами.
Хими́ческий потенциа́л μ - термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц.
В случае системы, состоящей из i компонентов, химический потенциал определяется как приращение внутренней энергии U системы при добавлении к системе бесконечно малого количества молей i-того компонента, отнесённое к этому количеству вещества, при постоянных объёме V, энтропии S и количествах молей каждого из остальных компонентов nj (j ¹ i).
| В общем случае химический потенциал может быть определён как приращение любого из остальных потенциалов термодинамических системы при различных постоянных параметрах: гиббсовой энергии G - при постоянных давлении р, температуре Т и nj; гельмгольцевой энергии А - при постоянных V, Т и nj; энтальпии Н - при постоянных S, р и nj. Таким образом: |
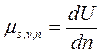 ; ; 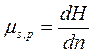 ; ; 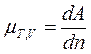 ; ; 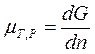
|
Внутренняя энергия системы Uвн складывается из энергии поступательного и вращательного движения молекул, энергии внутримолекулярного колебательного движений атомов и атомных групп, энергии, заключающейся в ядрах атомов, энергии межмолекулярного взаимодействия.
Uвн является полным дифференциалом, она не зависит от пути процесса, а зависит от начального и конечного состояний системы, она однозначно непрерывна и конечна. Абсолютное значение Uвн определить нельзя, можно определить только ее изменения.
Для гетерогенной системы изменение внутренней энергии, исходя из I и II начал термодинамики:
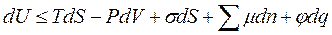
где dU - изменение внутренней энергии;
dS - изменение энтропии;
dV - изменение объема;
Т – температура;
Р – давление;
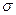 - поверхностное натяжение;
- поверхностное натяжение;
n - число молей компонента;
dq - изменение электрического заряда;
μ - химический потенциал компонентов;
φ - электрический потенциал компонентов;
S - межфазная поверхность.
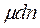 - появляется в том случае, когда имеется адсорбция,
- появляется в том случае, когда имеется адсорбция,
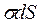 - поверхность,
- поверхность,
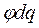 - для заряженных частиц (φ- эл. потенциал, q – заряд).
- для заряженных частиц (φ- эл. потенциал, q – заряд).
Из уравнения видно, что при увеличении температуры поверхностное натяжение снижается.
· для энтальпии
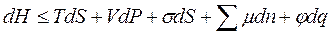
· для свободной энергии Гельмгольца
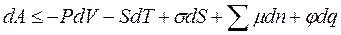
· для потенциала Гиббса
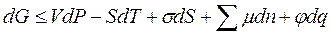
 2015-06-14
2015-06-14 1359
1359








