Биосинтетические пути регулируются преимущественно по механизму аллостерического ингибирования первого фермента и репрессии синтеза ферментов этого пути конечным продуктом. Регулирование разветвленных биосинтетических путей осуществляется с помощью усложненных вариантов этих же механизмов.
Основные механизмы, регулирующие катаболические пути, — индукция синтеза ферментов и катаболитная репрессия. Катаболические пути, в которых функционируют конститутивные ферменты, регулируются большей частью посредством аллостерических воздействий на активность ферментов. Одна из задач катаболических путей — обеспечение клетки энергией. У большинства прокариот возможности генерации энергии намного превышает потребности в ней клетки. Количество АТФ, которое можно синтезировать с помощью имеющихся в клетках аэробных прокариот ферментов гликолитического и дыхательного путей, значительно больше количества АТФ, необходимого для процессов биосинтеза и поддержания жизнедеятельности. Поэтому клетки должны обладать способностью контролировать потребление энергодающих субстратов и, следовательно, выработку клеточной энергии. Основной принцип контроля прост: АТФ синтезируется только тогда, когда он необходим, Иными словами, интенсивность энергетических процессов у прокариот регулируется внутриклеточным содержанием АТФ.
|
|
|
Адениловые нуклеотиды относятся к числу важнейших эффекторов. АМФ и АДФ действуют как положительные эффекторы, стимулирующие скорость энергетических процессов и, следовательно, повышающие выход АТФ. Наоборот, АТФ служит отрицательным эффектором, сигнализирующим о превышении процессов образования АТФ над его потреблением. В результате регуляции процессов синтеза и распада АТФ в клетке поддерживается стационарное энергетическое состояние, характеризующееся так называемым энергетическим зарядом клетки:
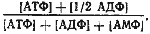
Величина энергетического заряда теоретически может колебаться от 1 (в клетке все адениловые нуклеотиды только в виде АТФ) до 0 (в клетке содержится только АМФ). В растущей культуре величина энергетического заряда клетки равна примерно 0,8. Уменьшение его свидетельствует об ухудшении энергообеспечения организма. Когда эта величина становится ниже 0,5, клетки погибают.
Помимо адениловых нуклеотидов в регулировании энергетических процессов активную роль играют система НАД(Ф)+/НАД(Ф)-H2 коферментов и величина трансмембранного электрохимического градиента ионов водорода в виде обоих его составляющих (pH и pH). Преобладание аллостерического взаимодействия восстановленной или окисленной форм НАД(Ф) с ферментами катаболического пути приводит соответственно к понижению или повышению их активности. Достижение определенного порогового значения H+ на энергопреобразующей мембране служит определенным сигналом, тормозящим поступление ионов водорода против градиента.
|
|
|
Регуляция процессов активного транспорта, обеспечивающего поступление подавляющего большинства необходимых прокариотам веществ, происходит на уровне синтеза переносчика и его функционирования. Биосинтез белковых компонентов многих транспортных систем регулируется по типу индукции. Глюкоза, транспортная система которой у большинства прокариот конститутивна, подавляет образование транспортных систем других сахаров и ряда органических кислот путем катаболитной репрессии. Исключение составляют некоторые облигатно аэробные прокариоты, у которых транспорт органических кислот конститутивен, а индуцируемой является транспортная система глюкозы. Избыток субстрата в среде может репрессировать синтез соответствующей транспортной системы. Это особенно характерно для аминокислот. В этом случае регуляция транспорта координирована с регуляцией их последующего метаболизма. Обнаружена также регуляция транспорта по типу отрицательной обратной связи, когда субстрат, накопленный внутри клетки, подавляет собственный транспорт из внешней среды. Таким образом, процессы клеточного транспорта находятся под контролем тех же механизмов, что и внутриклеточные анаболические и катаболические процессы.
Получение мутантов с нарушениями в системе регуляции клеточного метаболизма, приводящими к сверхсинтезу определенных метаболитов, широко используется для получения аминокислот, витаминов, полисахаридов и других веществ, имеющих практическое значение.
РЕГУЛЯЦИЯ МЕЖКЛЕТОЧНЫХ ВЗАИМОДЕЙСТВИЙ
Прокариоты синтезируют вещества, регулирующие не внутриклеточный метаболизм, а межклеточные взаимодействия. Особенностями этих веществ, называемых ауторегуляторами, являются выделение их в окружающую среду, проявление биологической активности в очень низкой концентрации (10–9 — 10–12 M) и воздействие не на организмы иного вида, а на другие особи (клетки) того же вида. Эти вещества выделяются клетками прокариот в обычных условиях культивирования и обнаруживают строгую видо- или родоспецифичность.
Как правило, реакция, вызываемая ауторегулятором, связана с жизненным циклом прокариот. Так, стадия формирования плодовых тел в жизненном цикле миксобактерий (см. рис. 21) индуцируется ауторегулятором. веществом липидной природы, выделяемом вегетативными клетками. Клетки Myxococcus xanthus выделяют вещества, вызывающие споруляцию этого вида при их концентрации в среде порядка 10–10 M. У Streptococcus faecalis установлен половой процесс. В клетках-реципиентах синтезируются специфические ауторегуляторы (половые регуляторы, или феромоны), под воздействием которых клетки-доноры приобретают способность прилипать к реципиенту. В результате повышается вероятность образования пары донор — реципиент.
Vibrio fischeri — обычный светящийся симбионт рыб семейства Monocentudae. Синтезируемый им ауторегулятор стимулирует образование нескольких компонентов системы свечения. Эффект обнаруживается при концентрации ауторегулятора 10 нМ, что соответствует примерно 1–2 молекулам этого соединения на бактериальную клетку. Оптимальная концентрация порядка 200 нМ (приблизительно 40 молекул ауторегулятора на клетку).
Несколько видов ауторегуляторов, контролирующих синтез антибиотика и спорообразование, обнаружено у актиномицета Streptomyces griseus. Необычное циклическое соединение, индуцирующее образование спор, идентифицировано в клеточных выделениях цианобактерии Cylindrospermum licheniforme.
|
|
|
Таким образом, прокариотные организмы синтезируют химические вещества-сигналы, регулирующие различные процессы, связанные с межклеточными взаимодействиями в популяции одного вида или даже штамма. Место действия ауторегуляторов — клеточные ферменты. Примечательно, что большинство изученных регуляторов — вещества липидной природы. Это позволяет им легко диффундировать через клеточные мембраны без помощи специальных транспортных систем. Феромоны S. faecalis — пептиды, содержащие 8 аминокислотных остатков, единственная гидрофильная аминокислота, входящая в состав этих пептидов, — серин. Гидрофобный характер пептидных феромонов S. faecalis также указывает на возможный неспецифический механизм их переноса через клеточные мембраны.
Выявление нового класса веществ — регуляторов жизнедеятельности прокариот на межклеточном уровне — интересно тем, что позволяет рассматривать эти организмы не просто как популяцию разрозненных клеток, но указывает на существование более высокого уровня их организации.
ГЛАВА 9. ПРОКАРИОТЫ И ФАКТОРЫ ВНЕШНЕЙ СРЕДЫ
Для прокариот как группы в целом характерна способность существовать в гораздо большем диапазоне условий внешней среды, чем для эукариотных организмов. Среди прокариот есть организмы, которые могут расти в подводных вулканических источниках (температура до 300°С), кислой (pH 1 и ниже) и щелочной (pH 11 и выше) среде, при давлении 1000 атм, высоких концентрациях тяжелых металлов, концентрации соли до 30%, высоких уровнях радиации. Обязательным условием для этого является наличие водной среды. Прокариоты растут при активности воды в диапазоне от 0,7 до 0,998 и не могут расти в аэрозолях и во льду22.
22 Активность воды (Aw) служит мерой ее доступности и определяется в соответствии со следующим уравнением:
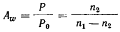
где Р — давление пара раствора, Р0 — давление пара растворителя (чистой воды); n 1 и n 2 — число молей растворителя и растворенного вещества соответственно.
ОТНОШЕНИЕ К МОЛЕКУЛЯРНОМУ КИСЛОРОДУ
Кислород широко распространен в природе, находясь как в связанном, так и свободном состоянии. В первом случае он входит в состав молекул воды, органических и неорганических. соединений. Во втором — присутствует в современной атмосфере в виде молекулярного кислорода (O2), объемная доля которого составляет 21%. Кислород является обязательным химическим компонентом любой клетки. Подавляющее большинство организмов удовлетворяет свои потребности в этом элементе, используя обе формы кислорода. При выращивании, Pseudomonas в присутствии 18O2 и H218O источником приблизительно 10% кислорода, входящего в состав клеточного материала, служил газообразный кислород, 50–60% клеточного кислорода происходило из воды. Остальной кислород в клетку поставляли органические и неорганические компоненты питательной среды (глюкоза, фосфаты, нитраты, сульфаты и др.).
|
|
|
|
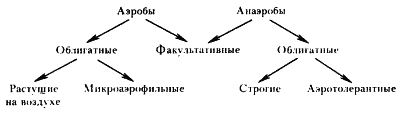
| Рис. 34. Группы прокариот в замисимости от отношения к молекулярному кислороду |
Среди прокариот существуют значительные различия в отношении к молекулярному кислороду. По этому признаку они могут быть разделены на несколько групп (рис. 34). Прокариоты, для роста которых O2 необходим, называют облигатными (обязательными) аэробами. К ним относится большинство прокариотных организмов. Среди облигатных аэробов обнаружены существенные различия в отношении к уровню молекулярного кислорода в среде. Некоторые представители этой группы не способны к росту при концентрации O2, равной атмосферной, но могут расти, если содержание O2 в окружающей среде будет значительно ниже (порядка 2%). Такие облигатно аэробные прокариоты получили название микроаэрофилов.
Потребность прокариот в низкой концентрации O2 в окружающей среде связана с их метаболическими особенностями. Многие аэробные азотфиксирующие бактерии могут расти в среде с молекулярным азотом только при концентрации O2 ниже 2%, т. е. как микроаэрофилы, а в присутствии связанного азота, например аммонийного, — на воздухе. Это объясняется ингибирующим действием молекулярного кислорода на активность нитрогеназы — ферментного комплекса, ответственного за фиксацию Na. Аналогичная картина обнаружена у многих водородокисляющих бактерий. На среде с органическими соединениями в качестве источника энергии они хорошо растут при атмосферном содержании O2. Если источником энергии является окисление молекулярного водорода, эти же бактерии для роста требуют низкой концентрации O2. Последнее связывают с инактивацией молекулярным кислородом гидрогеназы — фермента, катализирующего использование H2.
Наконец, среди облигатных аэробов существуют значительные различия в устойчивости к высоким уровням O2 в среде. 100%-ный молекулярный кислород подавляет рост всех облигатных аэробов. Многие аэробные бактерии могут формировать колонии на поверхности твердой питательной среды в атмосфере, содержащей 40% O2, но рост их прекращается, когда содержание СO2 в атмосфере повышается до 50%.
Известны прокариоты, для метаболизма которых O2 не нужен, т. е. энергетические и конструктивные процессы у них происходят без участия молекулярного кислорода. Такие организмы получили название облигатных анаэробов. К ним относятся метанобразующие архебактерии, сульфатвосстанавливающие, маслянокислые и некоторые другие эубактерии. До сравнительно недавнего времени считали, что облигатные анаэробы могут получать энергию только в процессе брожения. В настоящее время известно много облигатно анаэробных прокариот, которые произошли от аэробов в результате вторичного приспособления к анаэробным условиям, приведшего к потере способности использовать O2 в качестве конечного акцептора электронов в процессе дыхания. Такие облигатные анаэробы получают энергию в процессах анаэробного дыхания, т. е. переноса электронов по цепи переносчиков на CO2, SO42 – , фумарат и другие акцепторы.
В ряду облигатно анаэробных прокариот, не включающих O2 в метаболические реакции, существует широкий спектр степени устойчивости к молекулярному кислороду, находящемуся во внешней среде. Многие из облигатных анаэробов не выносят присутствия даже незначительных количеств молекулярного кислорода в среде и быстро погибают. Такие организмы называют строгими анаэробами. К числу строгих анаэробов относятся представители родов Bacteroides, Fusobacterium, Butyrivibrio, Methanobacterium и др. Маслянокислые бактерии, относятся также к группе облигатных анаэробов, но среди них есть виды, умеренно (Clostridium tetani, С. carnis, С. tertium, С. sporogenes) или достаточно высоко (C. perfringens, C. acetobutylicum) толерантные к O2. Наконец, молочнокислые бактерии, обладающие метаболизмом только анаэробного типа, могут расти в присутствии воздуха и выделены в отдельную группу аэротолерантных анаэробов23.
23 Некоторые авторы относят молочнокислые бактерии рода Lactobacillus к микроаэрофилам на том основании, что в их клетках содержатся флавопротеины, катализирующие перенос электронов с НАД-H2 на O2. Однако этот процесс не связан с получением клеткой энергии. См. также с. 334.
Хотя облигатно анаэробные бактерии в целом очень чувствительны к O2, они могут в природе находиться в аэробных зонах. Широкое распространение представителей рода Clostridium в местах с высоким парциальным давлением O2 объясняется наличием у них эндоспор, не чувствительных к молекулярному кислороду. Однако и многие не образующие спор строго анаэробные прокариоты обнаружены в природе в местах, где наблюдается активное развитие облигатных аэробов. Вероятно, совместное развитие с облигатными аэробами, активно потребляющими молекулярный кислород, приводящее к образованию зон с низкой концентрацией O2, создает возможности и. для развития строго анаэробных видов.
Описаны прокариотные организмы, которые могут расти как в аэробных, так и в анаэробных условиях. Изучение этого явления показало, что природа его различна. Бактерии, не нуждающиеся в O2 (последний не участвует в осуществляемых ими. метаболических реакциях), но способные расти в его присутствии, являются по типу осуществляемого ими метаболизма облигатными анаэробами, устойчивыми к O2 внешней среды. Примером таких организмов служат молочнокислые бактерии. Многие прокариоты, относящиеся к этой же группе, приспособились. в зависимости от наличия или отсутствия O2 в среде переключаться с одного метаболического пути на другой, например с дыхания на брожение и наоборот. Такие организмы получили название факультативных анаэробов, или факультативных аэробов. Представителями этой физиологической группы прокариот являются энтеробактерии. В аэробных условиях они получают энергию в процессе дыхания24. В анаэробных условиях источником энергии для них служат процессы брожения или анаэробного дыхания.
24 Среди факультативных анаэробов в условиях осуществления ими метаболизма аэробного типа также могут быть микроаэрофилы.
Потребность в O2 у аэробов определяется его участием в энергетических и конструктивных процессах. В первом случае O2 служит обязательным конечным акцептором электронов, во втором — участвует в реакциях (или единственной реакции) на пути многоступенчатого преобразования клеточных метаболитов или экзогенных субстратов. У облигатных аэробов большая часть O2 используется в качестве конечного акцептора электронов в реакциях, катализируемых цитохромоксидазами. Меньшая часть включается в молекулы с помощью ферментов, получивших общее название оксигеназ. В клетках факультативных анаэробов также содержатся цитохромоксидазы. У облигатных анаэробов нет ферментов, катализирующих взаимодействие с O2.
Данные о механизмах взаимодействия прокариот с молекулярным кислородом, токсических формах O2 и способах защиты от них у прокариот изложены в гл. 15.
ВЛИЯНИЕ ИЗЛУЧЕНИЯ
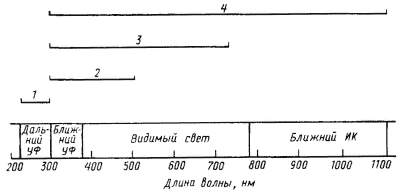
Все живые организмы находятся под воздействием разных видов излучения. Эффекты, вызываемые облучением живых организмов, зависят от длины волны излучения и его дозы, т. е. от энергии и количества поглощенных квантов (рис. 35). Излучение в области длин волн от 300 до 1100 нм, приходящееся в основном на видимый свет, обеспечивает возможность осуществления упорядоченных реакций при поглощении его подходящими для этого системами. В организмах излучение в этом диапазоне индуцирует такие процессы, как фотосинтез, фототаксис, фотореактивацию ДНК, синтез некоторых макромолекул. Для излучений с длиной волны больше 1100 нм к настоящему времени не зарегистрировано каких-либо биологических эффектов. Основное действие ИК-излучения — ускорение движения молекул (нагревание). Действие коротковолнового излучения на организмы приводит к возникновению мутаций или вызывает смертельный (летальный) исход из-за необычайно высокой фотохимической активности этого вида излучения, приводящего к модификации или разрушению поглотивших его органических молекул.
Важнейшим источником естественного излучения является солнечная радиация. Основная масса падающей на Землю солнечной энергии (примерно 75%) приходится на долю видимых лучей, почти 20% — на ИК-область спектра и только приблизительно 5% — на УФ с длиной волны 300 — 380 нм. Нижний предел длин волн солнечной радиации, падающей на земную поверхность, определяется плотностью так называемого озонового экрана. Излучение с длиной волны до 220 нм вызывает ионизацию молекул кислорода верхних частей атмосферы, приводя к образованию слоя озона (O3) с максимальной концентрацией на высоте примерно 25 км от поверхности Земли. Озоновый слой эффективно поглощает электромагнитное излучение с длинами волн в области 220 — 300 нм, выполняя функцию экрана. Таким образом, УФ с длиной волны до 220 нм полностью поглощается молекулами кислорода атмосферы, а в области 220 — 300 нм эффективно задерживается озоновым экраном. Важной частью солнечного спектра является область, примыкающая с обеих сторон к 300 нм. Начиная с 300 нм и дальше, излучение индуцирует фотосинтетические и фототактические реакции, при этом у прокариот диапазон длин волн, в котором возможны оба процесса, значительно шире, чем у эукариот (рис. 35).
|
| Рис. 35. Биологические эффекты, вызываемые излучением разной длины волны: 1 — повреждения ДНК и белков; 2 — фотореактивация ДНК; 3 — фототаксис и фотосинтез эукариот; 4 — фототаксис и фотосинтез прокариот |
Фотосинтез, сопровождающийся выделением O2, свойственный всем эукариотным организмам и двум группам эубактерий (цианобактериям и прохлорофитам), возможен в диапазоне от 300 до 750 нм. Для эубактерий, способных к осуществлению бескислородного фотосинтеза, диапазон излучений, обеспечивающих фотосинтетическую активность, увеличивается в сторону более длинных волн, захватывая ближнюю ИК-область: для зеленых бактерий вплоть до 840 нм, пурпурных — до 920 нм, а для некоторых представителей этой группы — до 1100 нм. Спектры активности фототаксиса у эубактерий совпадают со спектрами фотосинтетической активности, поскольку фоторецепторами в обоих случаях служат одни и те же пигменты. У экстремально галофильных архебактерий рода Halobacterium пигменты, запускающие фотосинтез и обеспечивающие фототактическую реакцию, различны и активны в диапазоне длин волн примерно от 450 до 600 нм (см. гл. 18).
Свет в диапазоне от дальнего УФ до дальней красной области влияет на разнообразные жизненные функции (подвижность, циклы развития, синтез каротиноидов) не только фототрофных, но и хемотрофных прокариот. Фоторецепторами, запускающими или контролирующими определенные метаболические пути, служат разные типы молекул: флавины, каротиноиды, порфирины. Солнечная радиация в диапазоне 220 — 300 нм, достигающая Земли, активно поглощается также молекулами белков и нуклеиновых кислот. Хотя повреждение негенетического материала может приводить к отрицательным эффектам, особенно при облучении клеток высокими дозами, при облучении более низкими дозами основной причиной инактивации клеток служит повреждение ДНК.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ
Температурные условия в биосфере достаточно разнообразны. Свыше 80% ее принадлежит к постоянно холодным областям. Значительная часть поверхности суши, включающая и континент Антарктиду, имеет низкую температуру. Средняя температура почвы в умеренной климатической зоне составляет 12°. Примерно 75% поверхности Земли приходится на долю Мирового океана, и около 90% его объема имеет температуру ниже 5°. Таков общий температурный профиль Земли.
Но на Земле есть много мест, резко различающихся по температурному режиму. Это области, где температура постоянно низкая (подземные и обледенелые пещеры, глубинные слои океанов) или высокая (действующие вулканы, выходы на поверхность земли струй паров и газов из расщелин или отверстий, кипящие или некипящие горячие источники, отходы различных технологических процессов). Есть также много областей с меняющимся температурным режимом: поверхностные слои морей и океанов, мелкие пресные водоемы и реки, верхние слои атмосферы, большинство мест на суше в зонах с умеренным и холодным климатом. Во многих областях с умеренным климатом температура колеблется от нуля и ниже до 30° и выше. В условиях холодного климата температурные колебания могут быть и более значительными.
При определении влияния температуры на прокариотные организмы следует различать два момента: способность организмов к выживанию после длительного нахождения в экстремальных температурных условиях и способность их к росту в этих условиях. Приспособления, сформированные у прокариот для перенесения неблагоприятных условий, в том числе и температурных, — это споры, цисты. Характеристика их устойчивости к высоким температурам приведена в табл. 8. Устойчивость вегетативных клеток и различных покоящихся форм больше в условиях воздействия низкими температурами. Так, вегетативные клетки и покоящиеся формы сохраняли жизнеспособность после длительного выдерживания при температуре, близкой к абсолютному нулю. Последнее используется в качестве одного из способов, обеспечивающих длительное хранение культур прокариот.
При изучении влияния температуры на рост прокариотных организмов выделяют температурный диапазон, ограниченный минимальной и максимальной температурами, при которых рост прекращается, а также область оптимальных температур с максимальной скоростью роста. Положение на температурной шкале основных точек (минимальная, максимальная, оптимальная температуры), а также величина температурного диапазона роста прокариот сильно различаются. На основании этих показателей прокариоты делят на три основные группы: мезофилы, психрофилы и термофилы. Последние в свою очередь подразделяются на отдельные подгруппы (рис. 36).
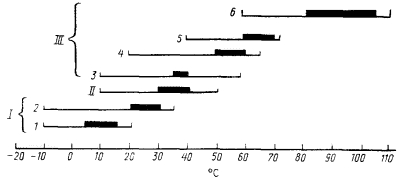
|
| Рис. 36. Температурные границы и оптимальные зоны роста прокариот и основанная на этом их классификация. I. Психрофилы: 1 — облигатные; 2 — факультативные. II. Мезофилы. III. Термофилы: 3 — термотолерантные; 4 — факультативные; 5 — облигатные; 6 — экстремальные. Жирной линией выделены оптимальные температуры роста |
Большинство известных видов относится к мезофилам, у которых оптимальные температуры роста лежат между 30 и 40°, а температурный диапазон, в котором возможен рост, находится между 10 и 45 — 50°. Типичным мезофилом является Е. соli: нижняя граница роста +10°, верхняя +49°, оптимальная температура +37° при росте на богатой среде.
Психрофилы и факторы, определяющие возможность роста при низких температурах. Область температур роста психрофилов лежит в пределах от — 10 до+ 20° и выше. В свою очередь психрофилы делятся на облигатных и факультативных.
Основное различие между подгруппами заключается в том, что облигатные психрофилы не способны к росту при температуре выше 20°, а верхняя температурная граница роста факультативных форм намного выше. Таким образом, факультативные психрофилы характеризуются более широким температурным диапазоном, при котором возможен их рост. И если в области низких температур они сходны с облигатными формами, то в области повышенных температур обладают способностью размножаться в значительно более высоких температурных границах. Различаются они также и оптимальными температурными зонами роста, находящимися у облигатных психрофилов значительно ниже, чем у факультативных (рис. 36). Принципиальное же сходство между ними — способность к росту при 0° и минусовых температурах.
Существование двух типов психрофилов объясняется особенностями их мест обитания. Облигатные психрофилы приспособились к устойчивым холодным условиям (глубины морей и океанов, ледяные пещеры). Напротив, психрофилы второго типа приспособились к обитанию в неустойчивых холодных условиях. В природе большинство психрофилов представлено факультативными формами. Способность психрофилов расти в условиях низких температур связывают в первую очередь с особенностями их ферментных белков и мембранных липидов. Увеличение в последних содержания ненасыщенных жирных кислот позволяет мембранам находиться в функционально активном жидкостно-кристаллическом состоянии при низких температурах. Обязательное условие возможности роста психрофилов при минусовых температурах — нахождение воды в жидком состоянии.
Термофилы и механизмы термофилии. Группу термофилов делят на 4 подгруппы:
1. Термотолерантные виды растут в пределах от 10 до 55 — 60°, оптимальная область лежит при 35 — 40°. Основное их отличие от мезофилов — способность расти при повышенных температурах, хотя.оптимальные температуры роста для обеих групп находятся на одном уровне.
2. Факультативные термофилы имеют максимальную температуру роста между 50 и 65°, но способны также к размножению при комнатной температуре (20°); оптимум приходится на область температур, близких к верхней границе роста. Особенность этой группы прокариот — способность к росту в области от 20 до 40°.
3. К облигатным термофилам относят виды, обнаруживающие способность расти при температурах около 70° и не растущие ниже 40°. Оптимальная температурная область облигатных термофилов примыкает к их верхней температурной границе роста. Представители этой подгруппы: эубактерии Bacillus acidocaldarius, Synechococcus lividus, архебактерии Methanobacterium thermoautotrophicum, Thermoplasma acidophilum и др.
4. Наконец, недавно обнаружены прокариоты, выделенные в подгруппу экстремальных термофилов. Для них характерны следующие температурные параметры: оптимум в области 80 — 105°, минимальная граница роста 60° и выше, максимальная — до 110°. К экстремальным термофилам относятся организмы из группы архебактерии, не имеющие аналогов среди мезофилов, например представители родов Thermoproteus, Pyrococcus, Pyrodictium и др.
Разнообразие прокариот, которые удается культивировать при высоких или относительно высоких температурах, достаточно велико. Способность расти при температурах от 50 до 70°, свойственная представителям термотолерантных, факультативных и облигатных термофилов, не связана с осуществлением ими какого-либо одного специфического типа метаболизма. Среди термофилов, относящихся к этим подгруппам, найдены фотосинтезирующие, хемолитотрофные и хемогетеротрофные бактерии. Есть среди них облигатные аэробы и анаэробы. Термофилы, верхний предел роста которых ограничен 70°, в целом структурно напоминают своих мезофильных аналогов и по типам осуществляемого ими конструктивного и энергетического метаболизма относятся к тем же группам, что и мезофильные; виды. По мере повышения температуры число видов, способных к росту, быстро уменьшается. Температурный предел для фотосинтезирующих эубактерии ограничен 70 — 73°. Это связывают с их неспособностью формировать функционально активные фотосинтетические мембраны.
Температурная ниша выше 70°, занятая экстремальными термофилами, гораздо беднее представителями. Верхний температурный предел, при котором зафиксирован рост в виде чистой бактериальной культуры в лаборатории, составляет 110°. Он обнаружен у архебактерии Pyrodictium occultum, растущей в диапазоне от 82 до 110° с оптимумом при 105°. Имеются также сообщения о том, что в природных условиях представители прокариот способны к росту при значительно более высоких температурах25.
25 Появились публикации об обнаружении бактерий, способных расти При температуре воды 250 — 300° и давлении 265 атм (при этом давлении Вода в жидком состоянии может находиться до 460°). Эти бактерии выделены из проб воды, поднятых с глубины 2560 м над поверхностью Тихого океана, где предположительно они существуют в горячих струях, выбрасываемых на дне океана так называемыми "черными гейзерами". Давление а районе обнаружения бактерий около 250 атм, а температура воды может быть выше 350°. В связи с этим исследователи начинают переоценивать Границы условий, при которых способны развиваться прокариоты. Высказывается предположение, что прокариоты могут существовать везде, где есть вода в жидком состоянии и достаточное количество питательных веществ.
Экстремальные термофилы относятся исключительно к архебактериям и представлены метанобразующими формами и видами, метаболизм которых связан с молекулярной серой. Почти все они — строгие анаэробы, но есть среди них и аэробы (представители рода Sulfolobus). Конструктивный метаболизм авто- или гетеротрофного типа. Анаэробные автотрофы получают энергию в результате восстановления CO2 или S0 молекулярным водородом с образованием в качестве конечных продуктов метана или сероводорода соответственно. Гетеротрофные экстремально термофильные анаэробы используют различные органические субстраты (белки, углеводы) для получения энергии в процессах брожения или анаэробного дыхания с молекулярной серой в качестве конечного акцептора электронов. Аэробные формы получают энергию в процессах, связанных с окислением молекулярной серы, железа или органических соединений. Большинство экстремальных термофилов не связано близким родством с нетермофильными изолятами.
Выяснение механизмов, обеспечивающих активное существование при высоких температурах, препятствующих в норме росту подавляющего большинства прокариот, представляет несомненный интерес. Проведенные в этом направлении исследования привели к убеждению, что термофилия включает множество молекулярных механизмов и не может быть объяснена только каким-нибудь одним свойством организма. Предложено несколько гипотез для объяснения природы термофилии. Одна из них подчеркивает роль мембранных липидов. Известно, что насыщенные жирные кислоты, входящие в состав липидов, имеют более высокую точку плавления по сравнению с ненасыщенными. Уже давно было замечено, что липиды термофилов имеют более высокие температуры плавления, чем липиды мезофилов, что достигается возрастанием содержания насыщенных жирных кислот в мембранах при повышении температуры культивирования. На основании этих данных и было высказано предположение, что липиды играют определенную роль в молекулярных механизмах термофилии, способствуя термостабильности мембран, и что нижняя температурная граница роста термофилов определяется температурой плавления мембранных липидов.
Многие исследователи считают, что определяющая роль в термофилии принадлежит белкам, в первую очередь ферментным. С этих позиций основные температурные точки термофилов зависят от конформации одного или нескольких ключевых ферментов: при минимальной температуре роста происходит переход от жесткой неактивной конформации белковых молекул к конформации с ограниченной гибкостью; оптимальная температура роста определяет наиболее благоприятное конформационное состояние ферментных белков; при максимальной температуре начинаются нарушения конформации белков и снижение их ферментативной активности, а выше этой температуры рост прекращается вследствие тепловой денатурации белков.
В одной из гипотез термофилии постулируется термостабильность структурных компонентов клетки термофилов. Оказалось, что клеточная стенка, мембраны, рибосомы термофилов „ значительно более термостабильны, чем соответствующие структуры мезофилов. Особенно большое внимание в этом плане привлекают клеточные мембраны.
Разобранные выше гипотезы, вероятно, вносят определенный вклад в механизм термофилии, дополняя друг друга, хотя не исключено, что молекулярные механизмы этого явления могут быть значительно шире и для их понимания необходимы дополнительные исследования. В природе нет четкого деления на группы, представленные на рис. 36. Из рисунка видно, что отмеченные на нем оптимальные температурные зоны для разных групп образуют почти непрерывный ряд температур, а температурные диапазоны, допускающие рост выделенных групп, значительно перекрываются.
ОТНОШЕНИЕ К КИСЛОТНОСТИ СРЕДЫ
Давно известно, что кислотность среды (концентрация водородных ионов, pH) является важным фактором, определяющим возможность существования прокариот. Концентрация ионов водорода в окружающей среде действует на организм прямо (непосредственное воздействие H+) или косвенно (через влияние на ионное состояние и доступность многих неорганических ионов и метаболитов, стабильность макромолекул, равновесие электрических зарядов на поверхности клетки).
При низких значениях pH растворимость углекислоты, являющейся основным или даже единственным источником углерода для автотрофных прокариот, понижается, а растворимость некоторых ионов (Cu2+, Мо2+, Mg2+, Al3+) возрастает и достигает уровней, токсичных для многих прокариот. Наоборот, при высоких значениях pH растворимость многих катионов (Fe2+, Са2+, Mg2+, Mn2+), необходимых клетке, резко понижается, они выпадают в осадок и, таким образом, становятся недоступными для организмов.
pH влияет на состояние веществ в окружающей среде. Органические кислоты в кислой среде находятся в недиссоциированной форме, в которой легко проникают в клетку, становясь токсичными для нее. Концентрация H+ внешней среды влияет и на равновесие электрических зарядов на поверхности клетки: при низких значениях pH увеличивается суммарный положительный заряд, при высоких — суммарный отрицательный заряд.
В Мировом океане и на большей части суши концентрация Водородных ионов поддерживается в довольно узком диапазоне, оптимальном для роста большинства прокариот, предпочитающих нейтральные или слабощелочные условия. Довольно часто встречаются умеренно кислые природные среды, имеющие pH около 3 — 4. Это многие озера, кислые болота, некоторые истощенные почвы. Среды с более низким pH чрезвычайно редки; pH 3 и ниже имеют обычно терриконы угольных шахт, дренажные воды, рудничные стоки.
К наиболее кислым из природных сред, вероятно, относятся горячие кислые источники и окружающие их горячие кислые почвы, pH которых может достигать 1. Из этих мест были выделены бактерии, являющиеся одновременно термофилами и ацидофилами. Это Sulfolobus acidocaldarius, факультативно автотрофная сероокисляющая архебактерия, растущая в области pH от 1 до 5,8 (оптимальная область pH — 2 – 3). Температурный оптимум выше 70°. S. acidocaldarius — обитатель горячих кислых источников, расположенных в разных частях земного шара. Другие обитатели таких мест — Bacillus acidocaldarius, Bacillus coagulans, Thermoplasma acidophillum. Из тех же мест (области, где температура ниже 55°) выделен и Thiobacillus thiooxidans.
Встречающиеся в природе щелочные условия обычно связаны с почвами. Таковы почвы, обогащенные щелочными минералами, экскрементами животных, разлагающимися белками. В таких почвах pH может достигать 10. Обнаружены также щелочные озера и источники, pH которых 8 – 11. Из таких мест выделены представители родов Bacillus, Pseudomonas, Flavobacterium, Streptococcus и др. Некоторые из нитрат- и сульфатвосстанавливающих бактерий могут существовать при pH выше 11. Цианобактерии обильно растут в природных средах с pH до 10.
В зависимости от отношения к кислотности среды прокариоты могут быть разделены на несколько групп (рис. 37). Оптимальный pH для роста подавляющего большинства прокариот, называемых нейтрофилами, — область, близкая к нейтральной, а рост возможен, как правило, в диапазоне от 4 до 9, считающемся нормальным. Типичными нейтрофилами являются разные штаммы Escherichia coil, Bacillus megaterium, Streptococcus faecalis. Предельные обнаруженные границы pH для роста представителей мира прокариот приблизительно от 1 до 12. Хотя многие способны расти или выживать при значениях pH, лежащих за пределами нормального диапазона, оптимум их роста обычно находится внутри этого диапазона. Такие прокариоты считаются кислото- или щелочеустойчивыми (толерантными). К кислотоустойчивым относятся многие бактерии, продуцирующие органические кислоты, например уксуснокислые, молочнокислые и др. Щелочетолерантны многие из энтеробактерий, устойчивые к величинам pH, близким к 9 — 10.
У некоторых видов адаптация к кислотности среды привела к тому, что оптимум pH для роста переместился в кислую (pH 4 и ниже) или щелочную (pH от 9 и выше) зону. Такие прокариоты названы ацидофильными или алкалофильными (кислото- или щелочелюбивыми) соответственно. Среди обеих групп выделяют облигатные формы, потерявшие способность расти в нейтральной области, и факультативные, сохранившие эту способность. Типичными представителями облигатных ацидофилов служат бактерии рода Thiobacillus. Из алкалофилов к облигатным можно отнести некоторых представителей рода Bacillus.
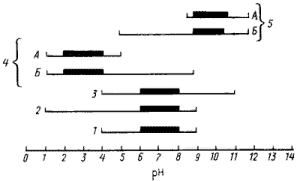
|
| Рис. 37. Границы и оптимальные зоны роста прокариот в зависимости от pH и основанная на этом их классификация: нейтрофилы (1); группы кислотоустойчивых (2) и щелочеустойчивых (3) прокариот; ацидофилы (4) и алкалофилы (5). Облигатные (А) и факультативные (Б) формы. Жирной линией выделен оптимальный pH роста |
Естественно, что способность к росту при низких или высоких значениях pH обеспечивает организму определенные преимущества, так как в этих условиях резко ограничена конкуренция со стороны других организмов. Механизм (или механизмы), обеспечивающий стабильность клеток и возможность их активного размножения при высоких и низких значениях кислотности, неизвестен. Естественно, что наиболее совершенными такие механизмы должны быть у облигатных ацидо- и алкалофилов. Для первых показано, что они не просто переносят высокие концентрации H+, но нуждаются в них для роста и стабильности. Например, Thermoplasma acidophilum лизируется при pH выше 5. В то же время все измерения внутриклеточного pH, проведенные у представителей групп облигатных ацидо- и алкалофилов, не оставляют сомнений в том, что он не соответствует pH внешней среды. У всех известных ацидофилов значение внутриклеточного pH поддерживается около 6,5, у нейтрофилов — 7,5, у алкалофилов — не выше 9,5. Прокариоты, растущие при экстремальных значениях pH, выработали разные механизмы для поддержания стабильного внутриклеточного pH. Облигатно ацидофильная T. acidophilum, например, поддерживает градиент pH, составляющий 4,5 единицы, вероятно, пассивно, за счет непроницаемости ЦПМ для ионов H+ (клеточная стенка у этого организма полностью отсутствует). У других прокариот дополнительно к ЦПМ таким барьером служит клеточная стенка. У ряда ацидофилов pH поддерживается благодаря активным метаболическим процессам, в основе которых лежат связанные с мембраной механизмы энергозависимого выталкивания ионов водорода (протонные помпы). У облигатных алкалофилов в поддержании цитоплазматического pH, более низкого по сравнению с наружным, ведущая роль принадлежит Na+/H+-антипортеру, катализирующему движение внутрь клетки протонов в обмен на ионы натрия, в которых эти бактерии нуждаются (см. рис. 26, Б).
В любом случае основными барьерами, обеспечивающими необходимый pH у облигатных ацидо- и алкалофилов, служат клеточная стенка и ЦПМ. Поиски особенностей строения этих клеточных структур не привели пока к расшифровке конкретных механизмов их устойчивости к высоким концентрациям H+ и OH+. Неизвестно также, почему облигатные ацидофилы и алкалофилы потеряли способность расти в нейтральной среде, т. е. почему высокие концентрации этих ионов стали для них совершенно необходимыми.
Среди облигатных ацидофилов четко выделяются две физиологические группы. К первой относятся организмы, растущие в кислой среде при умеренных температурах (мезофильные ацидофилы); в эту группу входят представители рода Thiobacillus. Вторую группу образуют термофильные ацидофилы, например, Bacillus acidocaldarius, Sulfolobus acidocaldarius, Thermoplasma acidophilum. Изучение структуры и химического состава клеточной стенки и мембран тиобацилл показало, что они имеют строение, типичное для грамотрицательных эубактерий. У тиобацилл не обнаружено каких-либо определенных структур или химических компонентов, ответственных за ацидофилию.
Среди термофильных ацидофилов наблюдается значительное разнообразие в строении и химическом составе клеточной стенки и мембран. Например, у эубактерий В. acidocaldarius клеточная стенка построена из типичного пептидогликана, а у архебактерии B. acidocaldarius состоит из регулярно расположенных на клеточной поверхности белковых субъединиц, прочно связанных с ЦПМ; пептидогликана в составе клеточной стенки не обнаружено. У микоплазмоподобной архебактерии T. acidophilum вообще нет клеточной стенки.
В мембранах термофильных ацидофилов обнаружены липиды необычного химического строения. У В. acidocaldarius компонентом липидов служат жирные кислоты, содержащие циклические группировки; у B. acidocaldarius и T. acidophilum — липиды, в состав которых входят длинные углеводородные цепи (C40). Исключительный интерес в этом плане представляет T. acidophilum, ЦПМ которой, непосредственно контактирующая с внешней средой (горячей и кислой), отличается необычайной прочностью: не разрушается при нагревании почти до 100°, обработке неионными детергентами, некоторыми ферментами, ультразвуком. Считается, что мембрана T. acidophilum наиболее жесткая из всех известных клеточных мембран. В мембранных белках этой архебактерии не найдено необычных аминокислот. Отмечено только резко сниженное количество полярных групп, обусловливающее гидрофобную природу ЦПМ.
Обнаруженные у термофильных ацидофилов особенности химического строения мембран нельзя, однако, прямо связать со свойством ацидофильности этих организмов, так как они одновременно находятся под двойным стрессовым воздействием (температуры и кислотности среды), тем более что их мезофильные аналоги (представители рода Thiobacillus) имеют довольно типичный химический состав клеточной стенки и мембран.
У облигатных алкалофилов пока также не обнаружено каких-либо особенностей в строении и химическом составе их клеточных стенок и ЦПМ. Алкалофилы представляют большой интерес с точки зрения их энергетики, так как при культивировании в оптимальных условиях (pH 9,0 – 10,5) концентрация H+ во внешней среде, как правило, ниже, чем в клеточной цитоплазме (pH 8 – 9) и, следовательно, создание протонного градиента в соответствии с хемиосмотической теорией П. Митчелла встречает определенные трудности (см. рис. 25). Недавно было показано, что алкалотолерантные и алкалофильные бактерии при работе дыхательной электронтранспортной цепи откачивают во внешнюю среду не протоны, а ионы натрия. Получено доказательство существования в мембране, генерирующей натриевый потенциал, Na+-зависимой АТФ-синтазы, способной синтезировать АТФ за счет Na+. Все ли алкалофильные и алкалотолерантные бактерии могут таким путем получать энергию, не известно. Однако есть данные о том, что облигатные алкалофилы сохранили способность синтезировать АТФ с участием H+-АТФ-синтазы. Поскольку pH у них имеет противоположную направленность, движущей силой служит электрический компонент — , величина которого может достигать 150–180 мВ.
ГЛАВА 10. ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ЭВОЛЮЦИИ ПРОКАРИОТ
Вся информация о признаках, присущих организму, сосредоточена в его генетическом аппарате. Он обеспечивает сохранение и воспроизведение этих признаков в процессе размножения организма, так как возникающие дочерние особи обнаруживают в большинстве случаев полное сходство с родительскими формами. Это говорит о том, что генетический аппарат обладает высокой стабильностью и точностью механизмов, обеспечивающих его функционирование. Однако стабильность генетического аппарата не абсолютна, так как это исключало бы всякую возможность его изменений и, следовательно, эволюционных преобразований, приведших в конечном итоге к возникновению разнообразных форм жизни, свидетелями (и представителями) которых мы являемся. Таким образом, генетический аппарат должен быть организован так, чтобы, с одной стороны, обеспечивать свою стабильность, с другой — быть достаточно пластичным, т. е. обладать способностью к изменчивости.
В этой главе мы обсудим применительно к прокариотам вопросы, касающиеся организации и функционирования генетического аппарата, определяющего свойства наследственности и изменчивости, а также изменения в генетическом материале и процессы, приводящие к этим изменениям. Постараемся также оценить вклад каждого из процессов в эволюцию прокариотных организмов.
ГЕНЕТИЧЕСКИЙ АППАРАТ ПРОКАРИОТ
Как это ни кажется в настоящее время парадоксальным, но до 40-х гг. нашего столетия немногие микробиологи думали, что бактерии обладают наследственностью, основанной на тех же принципах, которые установлены для высших организмов. Прокариоты не имеют ни оформленного ядра, ни хромосом, аналогичных таковым эукариотных клеток, поэтому считали, что бактерии в генетическом отношении представляют собой неупорядоченную форму жизни. Одним из первых к пониманию того, что бактерии и высшие организмы подчиняются общим генетическим законам, подошел М. Бейеринк, описавший у прокариот стабильные, легко распознаваемые и наследуемые изменения.
Генетический материал любой клетки представлен ДНК, информационные свойства которой определяются специфической последовательностью четырех нуклеотидов в полинуклеотидной цепи. Полуконсервативный механизм репликации ДНК, в результате которого из одной родительской двухцепочной молекулы образуются две дочерние молекулы, содержащие по одной родительской и одной вновь синтезированной комплементарной полинуклеотидной цепи, наилучшим образом обеспечивает идентичность исходной и синтезированных молекул и, следовательно, сохранность видоспецифической наследственной информации в ряду поколений клеток и организмов (см. гл. 4). Частота ошибок, возникающих в процессе репликации, порядка 10-7.
Реализация наследственной информации в процессе жизненного цикла (онтогенеза) организма — двухступенчатый процесс. Сначала с определенных участков ДНК информация подписывается (транскрибируется) в виде комплементарных нулеотидных последовательностей молекул иРНК, которая перемещается в цитоплазму, связывается с рибосомами и в рибосоме с иРНК осуществляется перевод (трансляция) генетической информации в определенную последовательность аминокислотных остатков молекулы белка.
Процесс транскрипции находится в клетке под строгим контролем, поэтому имеет место как неодинаковое транскрибирование во времени разных участков ДНК (генов), так и неодинаковая скорость, с которой гены могут транскрибироваться. В результате количество молекул иРНК в клетке, комплементарных разным генам, сильно различается. Хотя в целом механизмы синтеза ДНК и РНК сходны, процесс транскрипции не обладает той степенью точности, которая характерна для репликации ДНК. Однако поскольку иРНК не способна к самовоспроизведению, возникающие при ее синтезе ошибки в последующих клеточных генерациях не воспроизводятся и, следовательно, не могут наследоваться.
Информационные РНК служат матрицами для синтеза различных белковых молекул. Перевод генетической информации с "языка" нуклеотидов на "язык" аминокислот—сложный многостадийный процесс, включающий активацию аминокислот, образование ими комплексов с особым видом РНК (транспортными РНК, или тРНК), взаимодействие этих комплексов с иРНК, связанной с рибосомой, приводящее в конечном итоге к формированию полипептидной цепи, аминокислотный состав которой изначально запрограммирован в определенном участке ДНК. В осуществлении каждой из стадий, ведущих к синтезу молекулы белка, участвует несколько различных ферментов.
Хотя механизм трансляции отличается высокой точностью, вероятность ошибки в целом выше, чем в случае синтеза молекул ДНК и РНК. Наиболее уязвимый этап — "узнавание" с помощью фермента аминокислоты соответствующей молекулой тРНК. По имеющимся данным, частота возникновения ошибок на этом этапе порядка 10-4, что и определяет, возможно, уровень точности процесса синтеза белка в целом. Однако, как и в случае синтеза РНК, ошибки в процессе трансляции, приводящие к синтезу измененной молекулы белка, не воспроизводятся, если они не закодированы исходно в генетическом материале.
Таким образом, процессы транскрипции и трансляции, служащие для выражения в онтогенезе генетической информации, не приводят к наследованию изменений, возникающих при их функционировании. Только изменения, происходящие в молекулах ДНК, могут сохраняться в ряду поколений, поскольку они воспроизводятся в процессе репликации. Следовательно, в основе эволюции прокариот лежит способность к изменению только их генетического материала. У прокариот весь генетический материал, необходимый для жизнедеятельности, локализован в одной хромосоме, т. е. бактериальная клетка гаплоидна. В определенных условиях в клетках бактерий может содержаться по нескольку копий хромосомы.
У многих бактерий обнаружены нехромосомные генетические элементы: плазмиды, умеренные фаги и мигрирующие элементы (транспозоны и IS-элементы)26. Для плазмид характерно стабильное существование в нехромосомном состоянии. Транспозоны и IS-элементы входят, как правило, в состав хромосом, но способны переходить из хромосомы в плазмиду, поэтому также могут быть отнесены к нехромосомным генетическим элементам.
26 От англ. insertion sequences — вставные последовательности.
Изучение нехромосомных генетических элементов обнаружило, что общий объем ДНК, входящий в их состав, превышает объем генома каждой особи. Таким образом, у прокариот большой объем генетической информации оказывается рассредоточенным в нехромосомных элементах. Это заставляет по-новому подходить к вопросу об организации генетической информации в мире прокариот. В бактериальной хромосоме локализована генетическая информация, необходимая для существования конкретного вида бактерий в определенном диапазоне условий внешней среды: при наличии используемых источников углерода, азота, доступности или отсутствии молекулярного кислорода и т. д. Особенностью генетической информации, содержащейся в нехромосомных элементах, является ее необязательность для жизнедеятельности бактерий, т. е. в ее отсутствие бактериальная клетка жизнеспособна, но, как видно из дальнейшего материала, важная роль нехромосомных генетических элементов заключается в том, что они расширяют возможности существования бактериального вида, обеспечивают обмен генетическим материалом на большие расстояния по горизонтали и играют определенную роль в эволюции прокариот.
Плазмиды обнаружены у многих бактерий, принадлежащих к разным таксономическим группам. Количество плазмидной ДНК в клетке составляет обычно не более нескольких процентов от клеточного генома, а число плазмид колеблется от 1 до 38. Плазмиды — это линейные или кольцевые ковалентно замкнутые молекулы ДНК, содержащие от 1500 до 40 000 пар нуклеотидов. Большинство плазмид состоит из трех групп генов: участка ДНК, ответственного за автономную репликацию плазмиды в клетке; системы генов, обеспечивающих возможность переноса плазмид из одной клетки в другую; генов, определяющих свойства, полезные для клетки-хозяина. Отличительная особенность плазмид — способность к автономной репликации, поэтому минимальное количество ДНК, которое может быть названо плазмидой, — это фрагмент, обеспечивающий автономную репликацию плазмидной ДНК в клетке как единого целого.
Обычно о присутствии плазмид в бактериальной клетке судят по проявлению определенных признаков, к которым относится устойчивость к отдельным лекарственным препаратам, способность к переносу генов при конъюгации, синтез веществ антибиотической природы, способность использовать некоторые сахара или обеспечивать деградацию ряда веществ. Из перечисленного выше видно, что плазмиды делают возможным существование организмов в более широком диапазоне условий внешней среды, т. е. действуют как факторы адаптации. Большую группу составляют плазмиды с нерасшифрованными функциями; такие плазмиды выявляют с использованием физико-химических методов.
Мигрирующие элементы, представленные транспозонами и IS-элементами, — это линейные молекулы двухнитевой ДНК, размеры которых колеблются от 200 до 6000 пар нуклеотидов. Отличительная особенность мигрирующих элементов — их неспособность к автономной репликации. Мигрирующие элементы могут встраиваться в разные участки бактериальной хромосомы или мигрировать с бактериальной хромосомы на плазмиду; их репликация осуществляется под контролем тех же механизмов, что и у соответствующей хромосомы или плазмиды. Частота переносов (транспозиции) мигрирующих элементов колеблется от 10-4 до 10-7. IS-элементы содержат информацию, необходимую только для их переноса внутри клетки, никаких выявляемых признаков в них не закодировано. Транспозоны устроены более сложно: в них включены некоторые гены, не имеющие отношения к процессу транспозиции. Известны транспозоны, содержащие гены устойчивости к антибиотикам, ионам тяжелых металлов и другим ингибиторам.
Для переноса мигрирующих элементов между клетками нужен переносчик, которым могут быть определенные плазмиды или фаги. Встраивание мигрирующих элементов в бактериальную хромосому оказывает мутагенное действие, так как при этом происходит включение фрагмента ДНК, приводящее к изменению порядка расположения нуклеотидов в триплете и, как следствие этого, нарушению процесса транскрипции.
ИЗМЕНЕНИЕ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА
Первое, что поразило исследователей, когда они поближе познакомились с миром прокариот, — огромное разнообразие присущих им признаков. Это послужило в свое время основанием для дискуссии о том, существуют ли у прокариот реально очерченные виды, между которыми нет переходов, или же имеет место почти бесконечная вариабельность одного вида, так что в конечном итоге само понятие "вид" применительно к этим организмам теряет тот смысл, который в него вкладывается. Спор был разрешен после разработки Р. Кохом метода чистых культур. Было доказано, что и у бактерий вид — это реальность. Представления о простоте переходов между родами и видами оказались неверными.
В процессе экспериментальной работы с прокариотами исследователи часто наблюдали, что популяция одного вида при культивировании в течение длительного времени или в разных условиях подвержена изменениям. Накопилось огромное количество фактов, иллюстрирующих эти изменения, однако механизмы, лежащие в основе наблюдаемых явлений, были непонятны. И только успехи, достигнутые за последние десятилетия в области изучения строения и функционирования генетического аппарата прокариот, позволили разобраться в этом вопросе.
Прежде чем переходить к дальнейшему изложению материала, целесообразно ввести некоторые понятия. Генотипом, или геномом, называют совокупность всех генов, присущих данному организму, т. е. его генетическую конституцию. Под фенотипом понимают совокупность признаков, присущих данному организму. Оказалось, что все наблюдаемые изменения можно разделить на два типа. К первому относят те из них, которые, как правило, проявляются у подавляющего большинства особей в популяции при изменении внешних условий и наблюдаются до тех пор, пока действует фактор, вызвавший эти изменения. Такой тип изменчивости получил название не наследственного, или модификационного, а само явление названо модификацией.
Ко второму типу относятся изменения признаков, которые первоначально возникают как редкие события в популяции особей (с частотой 1 на 104—1011 клеток). Если измененные особи имеют некоторое преимущество перед неизмененными, выражающееся в повышенной скорости роста или жизнеспособности, они постепенно накапливаются в популяции и вытесняют исходные особи. Изучение особенностей второго типа изменений привело к заключению, что последние возникают случайно. И наконец, эти изменения постоянны, т. е. передаются из поколения в поколение при размножении организма. Такой тип изменчивости был назван наследственным.
Долгое время не было ясно, каков механизм модификационных изменений, могут ли они наследоваться и какова их роль в эволюции организмов. В настоящее время показано, что модификация — изменение, происходящее на уровне фенотипа и не затрагивающее клеточный генотип. Все признаки клетки определяются ее генотипом, но в определенных условиях она пользуется не всей заложенной в ней генетической информацией, количество которой гораздо больше, чем необходимо клетке для существования в конкретных условиях. Реакция клетки на изменение внешних условий приводит к проявлению какихто новых признаков, свойств, которые не обнаруживались в исходной культуре. Однако информация, необходимая для проявления этих признаков, обязательно содержится в клеточном Геноме. Модификация есть результат пластичности клеточного метаболизма, приводящего к фенотипическому проявлению "молчащих" генов в конкретных условиях. Таким образом, модификационные изменения имеют место в рамках неизменного клеточного генотипа.
Существует несколько типов модификационных изменений. Наиболее известны адаптивные модификации, т. е. ненаследственные изменения, полезные для организма и способствующие его выживанию в изменившихся условиях. Причины адаптивных. модификаций кроются в механизмах регуляции действия генов. Адаптивной модификацией является адаптация клеток Е. coli к лактозе как новому субстрату (см. гл. 8). У ряда бактерий обнаружена универсальная адаптивная реакция в ответ на различные стрессовые воздействия (высокие и низкие температуры, резкий сдвиг pH и др.), проявляющаяся в интенсивном синтезе небольшой группы сходных белков. Такие белки получили название белков теплового шока, а само явление — синдром теплового шока. Стрессовое воздействие на бактериальную" клетку вызывает ингибирование синтеза обычных белков, но индуцирует синтез небольшой группы белков, функция которых предположительно заключается в противодействии стрессовому воздействию путем защиты важнейших клеточных структур, в первую очередь нуклеоида и мембран. Еще не ясны те регуляторные механизмы, которые запускаются в клетке при воздействиях, вызывающих синдром теплового шока, но очевидно, что это универсальный механизм неспецифических адаптивных модификаций. Не все модификации обязательно адаптивны. При интенсивном действии многих агентов наблюдаются ненаследуемые изменения, случайные по отношению к вызвавшему их воздействию. Они проявляются только в условиях, которые их вызывают. Причины появления таких фенотипически измененных клеток связаны с ошибками процесса трансляции, вызванными этими агентами.
Таким образом, модификационная изменчивость не затрагивает генетической конституции организма, т. е. не является наследственной. В то же время она вносит определенный вклад в процесс эволюции. Адаптивные модификации расширяют возможности организма к выживанию и размножению в более широком диапазоне условий внешней среды. Возникающие в этих условиях наследственные изменения подхватываются естественным отбором и таким путем происходит более активное освоение новых экологических ниш и достигается более эффективная приспособляемость к ним.
Наследственные изменения можно подразделить на изменения, возникающие в результате мутаций и рекомбинаций генетического материала. Скачкообразные изменения в генетическом материале клетки, приводящие к появлению новых признаков, получили название мутаций. Мутации возникают в популяции особей всегда, часто без видимых воздействий на популяцию. Такие мутации, причины возникновения которых нам неизвестны, называются спонтанными. Повышать частоту мутаций по сравнению со спонтанным фоном, т. е. индуцировать их, могут физические, химические и биологические факторы, действующие на генетический материал клетки. Физические факторы — это прежде всего коротковолновое излучение (ультрафиолетовые и рентгеновские лучи). К химическим мутагенам относятся аналоги оснований, производные акридина, алкилирующие и дезаминирующие агенты. Биологические факторы — это в первую очередь мигрирующие элементы (транспозоны и IS-элементы).
Мутации, независимо от того, имеют ли они спонтанное происхождение или индуцированы какимлибо мутагеном, по характеру перестроек, происшедших в ДНК, можно разделить на мутации, состоящие в изменении одного нуклеотидного остатка молекулы ДНК, так называемые точковые мутации, и мутации, при которых наблюдается изменение участка молекулы ДНК размером больше одного нуклеотида. Точковые мутации в свою очередь могут быть разделены на несколько классов в зависимости от того, какие конкретно химические перестройки происходят в молекуле ДНК в рамках одного нуклеотидного остатка: замена, вставка или выпадение. К мутациям, затрагивающим сегмент бактериальной хромосомы, ведут выпадение нескольких оснований или даже генов, перемещение их в пределах одной хромосомы, умножение или удвоение части хромосомы.
Частым типом структурных повреждений ДНК, вызываемых УФизлучением, является образование пиримидиновых димеров в результате ковалентного связывания соседних пиримидиновых оснований. Реже УФ вызывает разрыв водородных связей, образование межцепочечных поперечных сшивок и поперечных сшивок между ДНК и белком. Ионизирующие излучения всех видов вызывают главным образом одноцепочечные разрывы в ДНК; разрывов, поражающих обе цепи, обычно на порядок меньше. Различные химические мутагены индуцируют образование внутрицепочечных и межцепочечных поперечных сшивок и одноцепочечные разрывы ДНК.
В процессе эволюции прокариоты выработали способы защиты генетического материала от повреждающего воздействия облучения и различных химических факторов. В клетках прокариот обнаружены эффективные системы репарации мутационных повреждений.
Наиболее изученными механизмами восстановления повреждений ДНК являются фотореактивация, вырезание повреждений и пострепликационное, или рекомбинационное, восстановление. Фотореактивация — наиболее простой механизм, восстанавливающий лишь индуцированные УФизлучением повреждения ДНК, сопровождающиеся образованием пиримидиновых димеров. Особенность фотореактивации в том, что ее действие распространяется только на одну цепь ДНК и не зависит от того, является ли молекул" В ДНК одно или двухцепочечной. Осуществляется фотореактивация светозависимым фотореактивирующим ферментом, обеспечивающим специфическое расщепление пиримидиновых димеров (рис. 38, А).
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
 Сейчас читают про:
|
 2015-06-16
2015-06-16 924
924







