Основой масс-спектрометрии является разделение ионов по величинам m/z (отношение массы к заряду) и измерение количества (интенсивностей) ионов каждого типа. Метод позволяет определять молекулярную массу и молекулярную формулу практически любого вещества, расходуя ничтожное (микро- или нанограммы) количество образца (метод разрушающего контроля). Кроме того, осколочные ионы несут полезную информацию о структуре изучаемого вещества.
При ионизации молекулы образуется молекулярный ион М+·, внутренняя энергия которого может быть достаточной для распада с выбросом нейтральной частицы m0 и образованием осколочного иона (фрагмента) А+:
М ® М+· ® А+ + m0.
Если осколочный ион А+ обладает достаточной внутренней энергией, то может происходить его дальнейший распад с образованием новых фрагментов.
Масс-спектр обычно представляют либо в нормализованной форме (в процентах от максимального, основного пика), либо в процентах от общего ионного тока в виде таблиц и графически (рис. 8.1).

|
| Рис. 8.1. Масс-спектр м- ксилола в нормализованной форме (интенсивность пика с т/z 91 равна 100 %) |
Для получения спектра в процентах от общего ионного тока сумма интенсивностей пиков всех ионов принимается за меру общего ионного тока, относительный вклад каждого иона рассчитывается в процентах.
Следует отметить, что пик молекулярного иона далеко не всегда бывает основным в спектре, если осколочные ионы более устойчивы, чем исходная молекула. Иногда распад осколочных ионов может происходить намного быстрее, чем их образование. Такие ионы будут иметь низкую интенсивность, но они важны для установления путей фрагментации (порядка, в котором происходит распад молекулярного иона на осколки).
Обычно в масс-спектрометрии наблюдаются однозарядные положительные ионы, но иногда образуются ионы с двумя, тремя зарядами. Чаще всего такие ионы встречаются в масс-спектрах ароматических соединений:
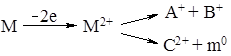 .
.
Масса двухзарядного иона в спектре равна m/2.
Кроме обычных узких пиков ионов, в масс-спектре часто наблюдаются уширенные пики низкой интенсивности, соответствующие метастабильным ионам. Их максимумам в спектре соответствуют, как правило, нецелочисленные значения m/z. Такие ионы широко используются для установления путей фрагментации. Если ион с массой m1 распадается с образованием иона с массой m2, то в спектре будет наблюдаться метастабильный ион m*= m22/ m1.
В атомной шкале масса 12С принята равной 12,0000, но другие элементы имеют нецелочисленные массы, например, масса 1Н равна 1,0078. Поэтому массы большинства ионов имеют нецелочисленные значения, хотя и близки к ним.
Разрешающая сила масс-спектрометра есть мера его способности разделять два иона с какой-либо определенной разницей масс. При низком разрешении масс-спектр состоит из ряда пиков с целочисленными значениями m/z. При сравнительно высоком разрешении пики могут быть расщеплены благодаря наличию ионов различного элементного состава. Ион с m/z 28 может соответствовать CO, N2 или С2Н4. Если имеются ионы всех этих типов, в спектре низкого разрешения будет наблюдаться только один пик с m/z 28, на приборах же с разрешением от среднего до высокого обнаруживаются три пика с m/z 27,9949, 28,0061 и 28,0313 соответственно.
Многие элементы имеют некоторое естественное содержание нескольких изотопов, и поскольку на масс-спектрометре измеряют отношение массы к заряду, эти изотопы проявляются в масс-спектре. Наиболее распространенный изотоп углерода – 12С, но природный углерод содержит также изотопы 13С и 14С. Природное содержание 14С настолько мало, что этот изотоп практически незаметен в масс-спектре, естественное содержание изотопа 13С составляет 1,08%. Поэтому, например, в масс-спектре наряду с пиком молекулярного иона с m/z 16, соответствующим 12СН4, имеется изотопный пик иона с m/z 17, соответствующим 13СН4, соотношение интенсивностей пиков этих ионов составляет 99:1. С ростом числа атомов углерода в молекуле возрастает вероятность включения хотя бы одного атома 13С. Соединение с двадцатью атомами углерода будет давать молекулярный ион М+ и изотопный пик иона с массой, большей на единицу [М+1]+, причем интенсивность последнего по отношению к М+ должна быть около 20×1,08=21,6%. С дальнейшим увеличением числа углеродных атомов возрастает вероятность включения двух атомов 13С в одну молекулу, и тогда становятся более заметными ионы [М+2]+.
Для некоторых элементов, обычно встречающихся в масс-спектрометрии органических веществ, в табл. 8.1 дано приблизительное естественное содержание наиболее распространенных изотопов.
Таблица 8.1
Естественное содержание наиболее распространенных изотопов
элементов, обычно встречающихся в органической масс-спектрометрии
| Элемент | Изотоп (% естественного содержания) |
| Водород | 1Н (99,99) |
| Углерод | 12С (98,9) 13C (1,1) |
| Азот | 14N (99,6) 15N (0,4) |
| Кислород | 16O (99,8) 18O (0,2) |
| Фтор | 19F (100,0) |
| Кремний | 28Si (92,2) 29Si (4,7) 30Si (3,1) |
| Фосфор | 31P (100,0) |
| Сера | 32S (95,0) 33S (0,7) 34S (4,2) |
| Хлор | 35Cl (75,5) 37Cl (24,5) |
| Бром | 79Br (50,5) 81Br (49,5) |
| Иод | 127I (100,0) |
Следует отметить, что сера, хлор и бром имеют наиболее распространенные изотопы, отличающиеся на две массовые единицы. По этой причине хлор- и бромсодержащие соединения особенно легко распознать по масс-спектру. При этом из анализа изотопных пиков в области молекулярного иона можно определить число атомов хлора и брома в молекуле.
На рис. 8.2 показана область молекулярного иона в масс-спектре дихлорбензола. Главные пики, отстоящие друг от друга на две массовые единицы, соответствуют изотопам 35Cl и 37Cl, а меньшие пики обусловлены вкладом изотопа 13С. Обычно за молекулярный ион принимают пик с наименьшей изотопной массой. Здесь молекулярному иону соответствуют все шесть пиков.
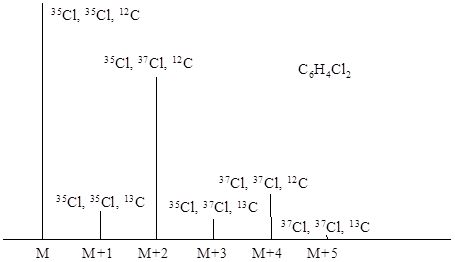
|
| Рис. 8.2. Изотопные вклады углерода и хлора в области молекулярного иона дихлорбензола |
Простой расчет вероятностей образования ионов показывает, что пики ионов М, М+2 и М+4 по интенсивности должны быть в соотношении 9:6:1. Число и относительную интенсивность изотопных пиков можно получить при разложении бинома (a + b)n, где n - число рассматриваемых атомов, a и b – относительное естественное содержание изотопов.
Если в ионе имеется два или более различных изотопсодержащих элемента, расчет относительной интенсивности ведется следующим образом: для иона, содержащего два атома хлора и два атома брома, относительное содержание составит:
для Cl2 (a + b)n = (3 + 1)2 = 9: 6: 1
для Br2 (a + b)n = (1 + 1)2 = 1: 2: 1.
Эти значения относительного содержания комбинируются следующим образом:
(9 6 1) ´ (1 2 1) ® (9 6 1) ´ 1 = 9 6 1
(9 6 1) ´ 2 = 18 12 2
(9 6 1) ´ 1 = 9 6 1
Сумма 9 24 22 8 1.
Таким образом, изотопная картина для иона, содержащего Cl2Br2, включает пять ионов М, М+2, М+4, М+6, М+8 с отношением интенсивностей пиков 9:24:22:8:1.)
Для интерпретации (расшифровки) масс-спектра прежде всего следует обратить внимание на условия его регистрации, которые влияют на характер масс-спектра. Расшифровку масс-спектра могут существенно облегчить данные о физических константах, методе получения, химических свойствах вещества, а также другие спектры изучаемого вещества.
Если пик молекулярного иона имеет низкую интенсивность или его отнесение (распознание) вызывает затруднение, то подтвердить правильность отнесения можно с помощью методов мягкой ионизации (химической ионизации и т.д.), позволяющих обнаружить более интенсивные квазимолекулярные ионы, чаще всего [М + Н]+.
Следует определить молекулярную формулу исследуемого вещества. Это можно сделать с помощью масс-спектрометрии высокого разрешения путем точного определения массы молекулярного иона, изучения относительных интенсивностей в кластере пиков молекулярного иона и сравнения их со справочными данными, использования результатов других методов анализа. Молекулярный ион с четным значением m/z не содержит атомов азота или содержит их четное число. Напротив, молекулярный ион с нечетным значением m/z содержит нечетное число атомов азота. Молекула с четным числом атомов азота и фосфора или галогена содержит четное число атомов водорода. При нечетном числе атомов указанных элементов число атомов водорода также будет нечетным.
Интенсивность пика молекулярного иона и общая картина осколочных ионов в масс-спектре иногда помогают отнести исследуемое соединение к определенному классу. Спектр, содержащий много пиков осколочных ионов, интенсивность которых увеличивается в направлении уменьшения значений m/z, как правило, указывает на алифатический характер соединения, тогда как спектр с небольшим числом пиков, содержащий интенсивный пик молекулярного иона и пики двухзарядных ионов, обычно соответствует ароматической структуре.
На следующей стадии расшифровки масс-спектра следует выделить главные осколочные ионы и попытаться установить основные направления распада ионов. Предполагаемый путь фрагментации лучше всего проверить путем поиска соответствующих метастабильных ионов.
Нужно всегда иметь в виду возможность присутствия примесей. Наиболее распространенными загрязнениями являются фталатные пластификаторы (m/z 149, 167, 279) и силиконовая смазка (m/z 133, 207, 281, 355, 429). Поскольку наблюдаемый масс-спектр зависит от парциального давления компонентов смеси в ионном источнике, то в нем может доминировать даже минорный (имеющийся в очень малом количестве), но более летучий компонент. При расшифровке состава осколочных ионов следует учитывать, что некоторые фрагментарные ионы могут возникать из перегруппированных предшествующих ионов.
Известно много различных типов масс-спектрометров. Принципиальная блок-схема прибора представлена на рис. 8.3. В системе прибора от ввода пробы до регистрации ионов включительно поддерживается вакуум.
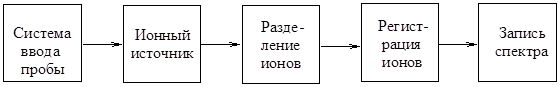
|
| Рис. 8.2. Принципиальная схема масс-спектрометра |
Ввод пробы возможен путем непосредственного ввода в ионный источник на конце металлического стержня (зонда), а также из колонки газового или жидкостного хроматографа. В случае сочетания масс-спектрометра с хроматографом требуется при помощи вакуумного насоса удалять из камеры ионизации газ-носитель (если ввод производится из колонки газового хроматографа) или элюент, который предварительно распыляют при нагревании, для испарения растворителя (если ввод производится из колонки жидкостного хроматографа).
Наиболее распространенный метод ионизации – это ионизация электронным ударом, заключающаяся в воздействии на изучаемое вещество (обычно при давлении около 10-6 мм рт. ст.) пучка электронов. Источником электронов служит нагретая катодная нить (чаще всего вольфрамовая). Электроны ускоряются в электрическом поле, создающемся в ионном источнике между катодом и анодом, разность потенциалов между которыми обычно составляет около 70 эВ. При такой энергии обычно образуются многочисленные осколочные ионы, полезные с точки зрения выяснения строения изучаемого соединения. При электронном ударе в вакууме образуются как положительно, так и отрицательно заряженные ионы. Хотя в принципе можно изучать и те и другие, в большинстве случаев масс-спектры с ионизацией электронным ударом регистрируют в режиме положительных ионов, которые образуются в большем количестве.
Современный ионный источник с ионизацией электронным ударом обычно позволяет работать и в режиме химической ионизации, при которой масс-спектры содержат меньше осколочных ионов, чем при ионизации электронным ударом. Химическая ионизация позволяет обнаружить молекулярные ионы, иногда отсутствующие в масс-спектрах с ионизацией электронным ударом. При химической ионизации исследуемое вещество (парциальное давление которого в ионном источнике составляет около 10-4 мм рт. ст.), смешивают в ионном источнике с газом-реагентом, находящимся в большом избытке (парциальное давление около 1 мм рт. ст.). Чаще всего в качестве газов-реагентов применяют метан, изобутан или амммиак. Смесь исследуемого вещества и газа-реагента подвергают электронному удару. При этом сначала ионизируются находящиеся в избытке молекулы газа-реагента, например, из метана образуются ионы СН4+· и СН3+. Поскольку давление газа-реагента довольно велико, то обычно в ионном источнике осуществляются ион-молекулярные реакции, приводящие к образованию вторичных ионов с небольшим избытком внутренней энергии:
СН4+· + СН4 ® СН5+ + СН3·
СН3+ + СН4 ® С2Н5+ + Н2 .
В конце концов вторичные ионы сталкиваются с молекулами изучаемого вещества и ионизируют их. Ионизация обычно осуществляется путем протонирования:
М + СН5+ ® [М + Н]+ + СН4.
Образующиеся так называемые квазимолекулярные ионы [М + Н]+ имеют четное число электронов и, следовательно, должны быть более устойчивыми, чем возникающие при электронном ударе молекулярные ион-радикалы. Сочетание большей устойчивости с низкой избыточной внутренней энергией приводит к тому, что в масс-спектрах с химической ионизацией квазимолекулярные ионы имеют весьма высокую интенсивность.
Ионы разделяют в соответствии с их отношением массы к заряду (m/z) в магнитном и (или) электрическом полях. Сочетание электрического и магнитного анализаторов дает масс-спектрометр с двойной фокусировкой, так как пучок ионов из ионной камеры сначала разделяется по кинетической энергии с помощью электрического поля, а затем ионы попадают в магнитное поле, напряженность которого изменяется таким образом, чтобы каждый ион с определенным значением m/z фокусировался на коллекторе ионов по очереди.
В масс-спектрометрах с квадрупольным анализатором разделение ионов осуществляется с помощью электронного фильтра, который представляет собой четыре стержнеобразных электрода. При подходящем радиочастотном поле между электродами пропускается только ион с определенной массой и предотвращается прохождение всех остальных ионов. Благодаря такому фильтрующему действию квадруполь часто называют фильтром масс. Изменяя частоту радиочастотного поля, можно чрезвычайно быстро сканировать весь спектр.
Регистрация масс-спектра может проводиться при помощи диодной матрицы, электрический сигнал с которой направляется на компьютер, производящий запись спектра.
Масс-спектроскопия используется в основном в химии нефти. По массе молекулярного иона можно с большой точностью определить молекулярную массу углеводорода или гетероатомного соединения, выделенного из нефти. По массе молекулярного иона, имея прибор с высокой разрешающей способностью, можно определить элементный состав вещества. При помощи масс-спектроскопии низкого разрешения можно определить качественный состав углеводородных смесей по массам молекулярных ионов компонентов.
Количественный анализ сложных смесей проводится в основном методом хроматомасс-спектрометрии. В этом случае используется блок из масс-спектрометра с газовым или жидкостным хроматографом, производящим разделение индивидуальных веществ. Далее вещества по очереди поступают в масс-спектрометр, который в данном случае можно рассматривать в качестве хроматографического детектора. Полученный масс-спектр можно обработать на ЭВМ, идентифицируя вещество и определяя его количественные характеристики. Метод хроматомасс-спектрометрии практически не имеет ограничений по возможностям анализа молекулярного состава любых смесей.
 2015-06-28
2015-06-28 7666
7666







