Пример 5. Рассчитайте изменение энтропии при нагревании 0.4 моль хлорида натрия от 20 до 850ºС. Температура плавления NaCl равна 800ºС, а Δ Н º пл составляет 31.0 кДж·моль–1. Мольные теплоемкости твердого и жидкого хлорида натрия равны
Сp (NaCl(тв)) = 45.94 + 16.32·10–3· T Дж·моль–1·К–1, Сp (NaCl(ж)) = 66.53 Дж·моль–1·К–1.
Решение. Разбиваем процесс на три стадии: нагревание твердого NaCl от 20 до 800ºС (∆S 1), его плавление (∆S 2) и нагревание жидкого NaCl от 800 до 850ºС (∆S 3):
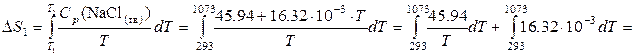
= 45.94 · ln 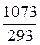 + 16.32·10–3 · (1073 – 293) = 59.6 + 12.7 = 72.3 Дж·моль–1·К–1;
+ 16.32·10–3 · (1073 – 293) = 59.6 + 12.7 = 72.3 Дж·моль–1·К–1;
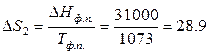 Дж·моль–1·К–1;
Дж·моль–1·К–1;
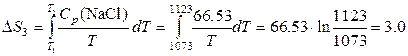 Дж·моль–1·К–1;
Дж·моль–1·К–1;
∆S = ∆S 1 + ∆S2 + ∆S3 = 72.3 + 28.9 + 3.0 = 104.2 Дж·моль–1·К–1.
Расчет выполнен для моля хлорида натрия. Для 0.4 моль:
∆S = 0.4 × 104.2 = 41.7 Дж×К–1.
Ответ: ∆S = 41.7 Дж×К–1.
Пример 6. Определите ∆H, ∆U и ∆S при превращении 2.7 кг воды, взятой при
p 1= 1.0133×105 Па и T 1= 293 K, в пар при p 2 = 0.50665×105 Па и T 2 = 373 K.
Cp (H2O(ж))» CV (H2O(ж)) = 4.187×103 Дж×кг–1×К–1, удельная теплота испарения ∆Hисп составляет 2260.98 × 103 Дж×кг–1. Считайте водяной пар идеальным газом.
|
|
|
Решение. Рассматриваемый переход между двумя состояниями происходит с изменением двух параметров (p и Т). Значения ∆H, ∆U и ∆S не зависят от пути процесса, и для их вычисления можно выбрать любой путь, состоящий из обратимых стадий, например:
1) нагревание воды при постоянном давлении p 1= 1.0133×105 Па от 293 до373 K;
2) превращение воды в пар при p 1 и T 2;
3) изотермическое расширение пара при T 2 от p 1 до p 2.
Изменение энтальпии равно сумме изменений энтальпии на каждой стадии:
∆ H = ∆ H 1+ ∆ H 2+ ∆ H 3.
 =
= 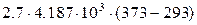 = 904.392 · 103 Дж;
= 904.392 · 103 Дж;
∆ H 2= m · Δ Hисп = 2.7 · 2260.98 · 103 = 6104.646 · 103 Дж;
∆ H 3= 0 (для идеального газа ∆ H зависит только от температуры).
Суммарно ∆ H = 904.392 · 103 + 6104.646 · 103 + 0 = 7009.038 · 103 Дж.
Изменение внутренней энергии также равно сумме изменений внутренней энергии на каждой стадии:
∆ U = ∆ U 1+ ∆ U 2+ ∆ U 3.
∆ U 1» ∆ H 1, поскольку для жидкостей Cp» CV;
∆ U 2= ∆ H 2 – p (V (г) – V (ж)).
Поскольку объем одного и того же количества вещества в жидкой фазе много меньше его объема в газовой фазе, пренебрегаем величиной V (ж) и получаем:
∆ U 2= ∆ H 2 – pV (г) = ∆ H 2 – nRT 2.
Подставим численные значения:
∆ U 2 = 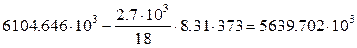 Дж;
Дж;
∆ U 3= 0.
Суммарно ∆ U = 904.392 · 103 + 5639.702 · 103 + 0 = 6544.094 · 103 Дж.
Рассчитаем изменение энтропии ∆ S = ∆ S 1 + ∆ S 2 + ∆ S 3.
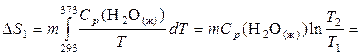
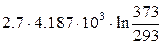 =
=
= 2.729 · 103 Дж×К–1;
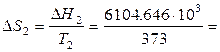 16.366 · 103 Дж×К–1;
16.366 · 103 Дж×К–1;
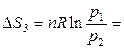
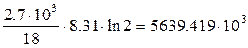 = 0.864 · 103 Дж×К–1.
= 0.864 · 103 Дж×К–1.
Суммарно ∆ S = (2.729 + 16.366 + 0.864) × 103 = 19.959 × 103 Дж×К–1.
Ответ: ∆ H = 7009.0 кДж, ∆ U = 6544.1 кДж, ∆ S = 19.959 кДж×К–1.
 2015-06-24
2015-06-24 4088
4088







