Лабораторная работа
ИЗМЕРЕНИЕ ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ
Цель работы: выполнение калориметрических измерений и термодинамических расчетов, связанных с энергетикойхимических реакций.
Приборы и реактивы: Калориметр, термометр, мерный цилиндр, кислоты (HCl и HNO3), щелочи (KOH и NaOH).
Теория
В любом процессе соблюдается закон сохранения энергии: теплота, подведенная к системе, расходуется на увеличение ее внутренней энергии U и на совершение системой работы А над внешней средой (первый закон термодинамики):
Q = U + A.
Если химическая реакция протекает в открытом сосуде при постоянных температуре и давлении (р, Т = const) и единственным видом совершаемой работы является работа расширения (А = p V ), то тепловой эффект этой реакции равенизменению энтальпии системы:
где Н = V + р V.
При ΔH > 0 (теплота подводится к системеиз окружающей среды) реакцию называют эндотермической, а при ΔH < 0 (теплота выделяется в окружающую среду) — экзотермической.
Если в уравнении химической реакции указан ее тепловой эффект, уравнение называют термохимическим. Например:
|
|
|
N2(г) + ЗН2(г) = 2NН3(г), ΔH = -92,4 кДж
При записи термохимических уравнений реакций указывают:
а) агрегатные состоянияили аллотропные модификации веществ;
б) условия протекания процесса (ΔH — стандартный тепловой эффект реакции при 298 К).
Экспериментальная часть
ОПЫТ 1. ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ НЕЙТРАЛИЗАЦИИ СИЛЬНОЙ КИСЛОТЫ СИЛЬНЫМ ОСНОВАНИЕМ
Для измерения тепловых эффектов реакций используют калориметрыили калориметрические установки (рис. 1). В наружный сосуд (стакан на 0,8 л) вставляется калориметрический стакан меньшей вместимости (0,5 л). Во избежание потерь теплоты через стенки калориметрического стакана между сосудами помещают пробковые прокладки. Калориметрический стакан закрывают деревянной крышкой с отверстиямидля термометра (ценаделения0,1 К), мешалки и воронки. Мешалку присоединяют к электромоторуили приводят в движение вручную. Теплоту, выделяющуюсяили поглощающуюся в калориметре вычисляют по формуле
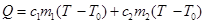 ,
,
где Т и T0— конечная и начальная температуры жидкости в калориметрическом стакане (К);
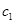 — удельная теплоемкость воды, равная 4,18 кДж/кгК;
— удельная теплоемкость воды, равная 4,18 кДж/кгК;
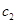 – удельная теплоемкость калориметрического стакана, равная 0,75 кДж/кгК;
– удельная теплоемкость калориметрического стакана, равная 0,75 кДж/кгК;
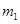 – масса воды в стакане, кг;
– масса воды в стакане, кг;
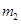 – масса калориметрического стакана, кг.
– масса калориметрического стакана, кг.
Удельную теплоту реакции нейтрализации определяют по форуле:
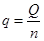 ,
,
где 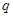 – удельная теплота нейтрализации, кДж/моль;
– удельная теплота нейтрализации, кДж/моль;
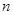 – количество вещества, моль.
– количество вещества, моль.
Согласно теории электролитической диссоциации, нейтрализация сильной кислотысильным основанием в разбавление отвечает уравнению Н+ + ОН- = Н2О. Стандартная теплота нейтрализации сильной кислоты сильным основанием равна - 55,9 кДж/моль H2O. Термохимическое уравнение реакции нейтрализации имеет вид:
|
|
|
Н+(ж) + ОН-(ж) = Н2О (ж), ΔH=-55,9 кДж/моль.
В опыте используют 1 М растворы КОН, NaOH, HCl, HNO3. Для нейтрализации берут равные объемы (50—150 мл) растворов кислоты и щелочи.
Порядок выполнения опыта следующий:
а) Получите у преподавателя задание и запишите его в лабораторный журнал.
б) Взвесьте сухой калориметрический стакан (с точностью до 0,1 г) или узнайте его массу у лаборанта.
в) Соберите калориметрическую установку (рис. 1) и через воронку налейте в сосуд заданный объем 1 М раствора щелочи; запишите температуру раствора щелочи Тщ с точностью до 0,1 К.
г) Налейте в мерный цилиндр такой же объем 1 М раствора кислоты и измерьтетемпературу раствора Тк с той же точностью. Начальная температура смеси кислоты и щелочи Т0 — среднее арифметическое от Тщ и Тк.
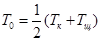
Массу жидкости в калориметрическом стакане определить по формуле: 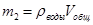
При работающей мешалке через воронку быстро влейл кислоту в калориметрический стакан и отметьте самую высокую температуру Т, которую покажет термометр после сливания растворов. Данные опыта сведите в таблицу:
Таблица 1. – Результаты эксперимента
| № п/п | Реакция | Vк, мл | Vщ, мл | Vобщ, мл | Тк, К | Тщ, К | Т0, К | Q, кДж | q, кДж/моль |
| HCl + KOH = KCl + H2O | |||||||||
| HCl + NaOH = NaCl + H2O | |||||||||
| HNO3 + KOH = KNO3 + H2O | |||||||||
| HNO3 + NaOH = NaNO3 + H2O |
По полученнымданным определите:
1. Разницу температур (Т — Т0).
2. Массу жидкости в калориметрическом стакане (при расчете считать плотность жидкости равной единице).
3. Теплоемкость системы.
4. Количество теплоты, выделившейся при реакции,
5. Число молей нейтрализованной кислоты (щелочи) или число молей полученной воды, учитывая заданную молярную концентрацию кислоты и щелочи.
6. Теплоту выделившуюся при нейтрализации кислоты и щелочи (кДж).
7. Удельную теплоту нейтрализации сильной кислоты сильным основанием.
8. Сравните полученную теплоту нейтрализации с теоретической и рассчитайте абсолютную и относительную ошибку опыта. Объясните причины погрешностей.
9. Объясните убыль энтальпии в процессе нейтрализации сильной кислоты сильным основанием.
 2015-06-24
2015-06-24 1257
1257






