В химии часто используются гетерогенные (неоднородные) системы, состоящие из двух и более фаз, например, реакции осаждения.
Особенность реакций осаждения заключается в том, что в результате растворения образуется новая фаза – твердое вещество и возникает гетерогенная двухфазная система: раствор – осадок (существует равновесие между осадком, образующимся при осаждении, и раствором, соприкасающимся с осадком соответствующего вещества).
Осадки, используемые в химическом анализе, относятся к различным классам химических соединений - это соли, основания и кислоты. Чаще всего используют малорастворимые соли. Соли неорганических кислот представляют собой, как правило, сильные электролиты и в растворах практически полностью диссоциируют на ионы.
Основные закономерности для случая, когда осадок образован малорастворимым электролитом, кристаллическая решетка которого построена из ионов, можно представить следующим образом:
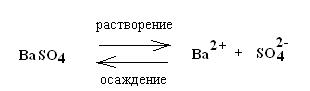
Таким образом, в насыщенном растворе неорганической малорастворимой соли МnАm содержатся в основном только отдельные ионы Мm+ и An-, которые находятся в равновесии с твердой фазой МnAm:
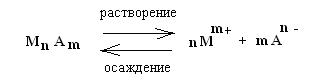
К такой системе применим закон действующих масс:
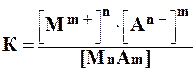
Константа равновесия не зависит от абсолютного количества твердой фазы и при данной температуре является величиной постоянной.
При установившемся равновесии скоростей осаждения и растворения осадка в насыщенном растворе малорастворимого электролита при данной температуре и давлении произведение концентраций (активностей) его ионов есть величина постоянная. Эту константу называют произведением растворимости ПР (Lp – в немецкой литературе, Sp – в английской) или произведением активностей:
ПР(MnAm) = [Mm+]n · [An-]m (3.2)
Из уравнения (3.2) видно, что при увеличении концентрации катионов осадка уменьшается концентрация анионов (и наоборот), поскольку при возрастаний концентрации ионов Мm+ или An- увеличивается вероятность встречи между ними. При этом скорость осаждения увеличивается по сравнению со скоростью реакции растворения осадка, и поэтому концентрация других разновидностей ионов в растворе уменьшается.
Равновесные молярные концентрации ионов Mm+ и An- пропорциональны растворимости S (моль/л) вещества МnАm:
[Mm+] = n? S [An-] = m? S,
тогда ПР = (n? S)n ? (m? S)m (3.3)
По значениям ПР можно сравнивать растворимость различных веществ. Например, из значений ПР для CaF2 (4,0?10-11) и BaF2 (1,7?10-6) можно заключить, что фторид кальция хуже растворим, чем фторид бария.
Численные значения произведения растворимостей приведены в справочниках (cм. приложение). Пользуясь ими, можно вычислить растворимость малорастворимого электролита в системе: раствор - осадок. Напоминаем, что растворимость S малорастворимого соединения - это концентрация его ионов в растворе над осадком.
ПРИМЕР 3.1 Произведения растворимости AgCl и Ag2CО3 равны соответственно 1,6?10-10 и 6,2?10-12 при 250С. Какая соль более растворима?
Решение: Определим молярные концентрации ионов в насыщенных водных растворах. AgCl = Ag++Cl-
Если с1 моль AgCl перешло в раствор, то [Ag+] = [С1-] = с1.
ПР(АgС1) = [Ag+] [С1-] = c12
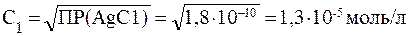
Для второй соли: Ag2CО3 = 2Ag+ + CO32-
Если растворилось с2 моль Ag2CО3, то:
[Ag+] = 2с2; [СO32-] = с2; ПР (Ag2CО3) = [Ag+]2 ? [СО32-] = (2c2)2 ? c2 = 4c23;
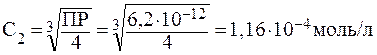
При сравнении с1 и с2 видно, что растворимость карбоната серебра в 10 раз выше растворимости хлорида серебра, хотя ПРAgCl > ПРAg2C03 и, казалось бы, растворимость АgС1 должна быть выше. Расчет показывает, что качественное сравнение растворимостей по величине ПР возможно лишь для веществ, образующих в растворах одинаковое суммарное число ионов. Например: ПРAgCl = 1,6? 10-10; ПРAgI = l,0? 10-16; с(AgCl) > с(AgI); ПРAg2CO3 = 6,2? 10-12; ПРAg2CrO4 = 2,0? 10-12; с(Ag2CO3) > c(Ag2CrO4).
Под растворимостью обычно понимают концентрацию ионов металла в насыщенном растворе малорастворимой соли.
Соотношения (3.2) и (3.3) позволяют рассчитывать значения ПР по известной растворимости веществ и, наоборот, растворимость веществ по известным ПР при Т= const.
ПРИМЕР 3.2 Определите ПР фторида магния, если его растворимость (S) в воде равна 0,001 моль/л при некоторой температуре.
Решение: Mg2+ + 2F- ↔ MgF2(T).
ПP = [Mg2 + ][F-]2 = S · (2S)2 = 4 · S3 = 4 · (0,001)3 = 4? 10-9.
ПРИМЕР 3.3 Растворимость Ag2CО3 равна 3,17·10-2г/л (при 200С). Вычислить произведение растворимости.
Решение: Пересчитаем концентрацию Ag2CO3, выраженную по условию задачи в граммах на литр, в моль на литр. Для этого разделим растворимость Ag2CO3 в единицах моль/л на молярную массу Ag2CO3:
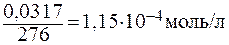
Составляем уравнение диссоциации соли:
Ag2CО3 ↔ 2Ag+ + CO32-.
1 моль Ag2CO3 распадается на 2 моль Ag+ и 1 моль СО32-. Следовательно, 1,15 · 10-4 моль Ag2CO3 дают 2,3 · 10-4 моль Ag+ и 1,15 · 10-4 моль СО32-.
Отсюда: [Аg+] = 2,3 · 10-4 и [СО32-]= 1,15 · 10-4.
Вычисляем ПР:
ПР = [Аg+]2 · [СО32-] = (2,3 · 10-4)2 · (1,15 · 10-4) = 6,08 · 10-12.
В общем случае для осадка МmАn растворимость в воде вычисляют по формуле:
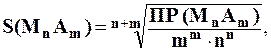 (3.4)
(3.4)
где m + n – суммарное число катионов и анионов;
ПР – произведение растворимости вещества;
m – число молей катионов в уравнении диссоциации вещества;
n – число молей анионов в уравнении диссоциации вещества.
Формула (3.4) справедлива в том случае, если можно пренебречь влиянием ионной силы раствора и протеканием конкурирующие реакций.
В реальных условиях анализа сравнительно редко приходится иметь дело с насыщенными растворами малорастворимых соединений, не содержащими каких-либо посторонних ионов, которые способны взаимодействовать с ионами осадка. Эти конкурирующие реакции приводят к увеличению растворимости.
Так, катионы осадка могут вступать во взаимодействие с каким-либо лигандом, образуя комплексы, анионы осадка в свою очередь могут подвергаться протонизации.
Правило постоянства произведения концентраций следует из применения закона действия масс к насыщенному раствору малорастворимого электролита. Однако это правило имеет приближенный характер, потому что равновесие между осадком и раствором характеризуется более сложной зависимостью.
При введении в насыщенный раствор труднорастворимой соли постороннего электролита состояние равновесия нарушается, часть твердой фазы будет переходить в раствор и растворимость осадка увеличится.
Процесс растворения твердой фазы проходит до тех пор, пока активность ионов в растворе, т. е. их способность к взаимным столкновениям, не станет такой же, как и до введения в раствор постороннего электролита. После этого снова установится динамическое равновесие между осадком и ионами раствора. Поэтому постоянной величиной является не произведение концентрации ионов, а произведение их активности.
Активность – величина, учитывающая отклонения от законов идеальных растворов, связанные с различными взаимодействиями между частицами растворенного вещества, а также растворенного вещества и растворителя.
Правило произведения растворимости: в насыщенном растворе малорастворимой соли произведение активностей ионов при постоянной температуре и давлении является величиной постоянной.
ПА(MnAm)=(аMm+)n·(аAn-)m (3.5)
Величину ПА называют произведением активности; она, в отличие от произведения растворимости, не зависит от концентрации посторонних ионов в растворе. Формулу (3.5) используют, если нельзя пренебречь влиянием ионной силы раствора.
Связь между произведением растворимости и произведением активности можно установить, исходя из следующей зависимости:
а = f · с, (3.6)
где а - активность;
с - концентрация раствора. моль/л.
Для расчета коэффициентов активности применяют правило ионной силы раствора:
I = 1/2 (CA · Z2A + CB · Z2B) ·, (3.7)
где I – ионная сила раствора;
СА - концентрация иона А, моль/л;
ZА – заряд иона А;
СВ – концентрация иона В. моль/л;
ZВ – заряд иона В.
Тогда коэффициент активности можно рассчитать по формуле:
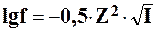 (3.8)
(3.8)
Значением ПР без поправок на ионную силу раствора можно пользоваться только при I < 0,0001, когда коэффициенты активностей близки к единице.
С увеличением концентрации ионов возрастает ионная сила раствора (сила электростатического притяжения ионов) и уменьшается кинетическая энергия движения ионов, т.е. уменьшается их активность.
ПРИМЕР 3.4. Вычислить растворимость Ag2CrО4 в г/л с учётом коэффициентов активностей всех ионов. ПР Ag2CrО4 = 1,2·10-12.
Решение: Растворимость осадка в моль/л без учёта коэффициентов активностей вычисляют непосредственно по произведению растворимости:
ПР Ag2CrО4 = [Ag+]2 · [CrO42-] = (2 х)2 · х = 4 x 3 = 1,2 · 10-12; х = 6,7 · 10-5 моль/л.
[CrO42-] = 6,7 · 10-5 моль/л; [Ag+] = 2 · 6,7 · 10-5 моль/л.
Далее вычисляют ионную силу раствора и коэффициенты активностей: J = 1/2 · (2 · 6,7 · 10-5? 12 + 6,7 · 10-5 · 22) = 4 · 10-4.
По справочнику находим для J = 4 · 10-4: fAg+ = 0,98, fCrO42- = 0,94.
Тогда ПР Ag2CrО4 = fAg+ · [Ag+]2 · fCrO42- · [CrO42-].
0,98 · (2 х)2 · 0,94 · х = 1,2 · 10-12
х = 6,9 · 10-5 моль/л или 6,9 · 10-5 · 331 = 0,023 г/л.
В присутствии посторонних электролитов коэффициенты активности ионов, которые зависят от ионной силы раствора, всегда меньше единицы. Отсюда можно заключить, что произведение растворимости, а также и растворимость малорастворимых соединений увеличивается в растворах с повышением концентрации сильных электролитов.
При добавлении реактива, в котором содержатся ионы, одноименные с ионами осадка, растворимость осадка уменьшается. Этим широко пользуются в химическом анализе.
 2015-06-24
2015-06-24 45459
45459
