Так как электролиты в растворах образуют ионы, то для отражения сущности реакций используют ионные уравнения, показывающие, что в растворах происходят реакции не между молекулами, а между ионами.
Правило Бертолле: Реакции между ионами в растворах электролитов идут практически до конца и необратимы в сторону образования осадков, малорастворимых, малодиссоциирующих, газообразных и комплексных соединений.
При составлении ионно-молекулярных уравнений надо помнить о том, что малорастворимые, малодиссоциирующие и газообразные вещества записываются в виде молекул, а сильные электролиты – в виде тех ионов, на которые они диссоциируют.
NH4OH + HCI→NH4CI + H2O
NH4OH + H+→NH4+ + H2O
BaCI2 + K2SO4→BaSO4 + 2KCI
Ba2+ + SO42−→BaSO4¯
K2S + 2HCI→H2S + 2KCI
S2− + 2H+→H2S
HgI2 + 2KI→K2[HgI4]
HgI2 + 2I−→[HgI4]2−
Константы диссоциации малорастворимых солей и гидроксидов металлов принято называть произведением растворимости (ПР).
Растворение твердого вещества в воде прекращается тогда, когда образуется насыщенный раствор, т.е. устанавливается равновесие между твердым веществом и частицами того же вещества, находящегося в растворе.
|
|
|
Так, например, в насыщенном растворе хлорида серебра устанавливается равновесие:
AgCI (к)⇆Ag+(р) + CI−(р)
осадок в растворе
Применив к этому уравнению закон действующих масс, получим
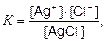
где [AgCI(к)] – концентрация молекул соли, моль/л; величина постоянная.
K [AgCI] = ПР = [Ag+] ∙ [CI−] = const.
Таким образом, в насыщенном растворе электролита произведение равновесных концентраций его ионов с учетом соответствующих стехиометрических коэффициентов есть величина постоянная при данной температуре. Эта величина количественно характеризует способность электролита растворяться, называют ее произведением растворимости.
Са(OH)2→Са+2 + 2OH−;
ПР = [Са+2] ∙ [OH−]2
ПР = [Kt+ n ] m ∙ [An- m ] n
Условия образования и растворения осадков:
[Kt+ n ] m [An- m ] n > ПР – осадок выпадает;
[Kt+ n ] m [An- m ] n < ПР – осадок растворяется (не выпадает);
[Kt+ n ] m [An- m ] n = ПР система находится в равновесии.
Обменные реакции между электролитами в растворах всегда идут в сторону образования менее диссоциированных или менее растворимых электролитов:
CaSO4 + 2NaF®CaF2 + Na2SO4,
ПРCaF2 = 4 × 10−11, ПРCaSO4 = 1,3 × 10 −4.
Поэтому реакция идет в сторону образования менее растворимого фторида кальция. Зная ПР можно определить растворимость данного элемента.
 2015-05-13
2015-05-13 2070
2070








