Витамин В1, был первым витамином, выделенным в кристаллическом виде К. Функом в 1912 г. Позже был осуществлен его химический синтез. Свое название — тиамин — получил из-за наличия в составе его молекулы атома серы и аминогруппы.
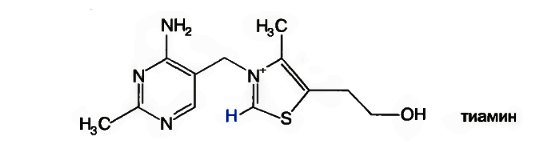
Тиамин состоит из 2-х гетероциклических колец — аминопиримидинового и тиазолового. Последнее содержит каталитически активную функциональную группу — карбанион (относительно кислый углерод между серой и азотом).
Тиамин хорошо сохраняется в кислой среде и выдерживает нагревание до высокой температуры. В щелочной среде, например при выпечке теста с добавлением соды или карбоната аммония, он быстро разрушается.
В желудочно-кишечном тракте различные формы витамина гидролизуются с образованием свободного тиамина. Большая часть тиамина всасывается в тонком кишечнике с помощью специфического механизма активного транспорта, остальное его количество расщепляется тиаминазой кишечных бактерий. С током крови всосавшийся тиамин попадает вначале в печень, где фосфорилируется тиаминпирофосфокиназой, а затем переносится в другие органы и ткани.
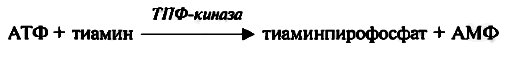
Существует мнение, что основной транспортной формой тиамина является ТМФ.
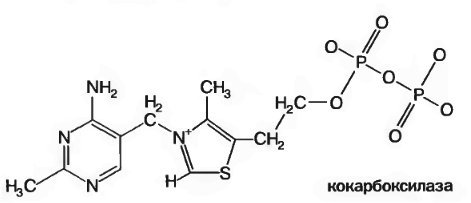
Витамин В1, присутствует в различных органах и тканях как в форме свободного тиамина, так и его фосфорных зфиров: тиаминмонофосфата (ТМФ), тиаминдифосфата (ТДФ, синонимы: тиамин пирофосфат, ТПФ, кокарбоксилаза) и тиаминтрифосфата (ТТФ).
ТТФ — синтезируется в митохондриях с помощью фермента ТПФ-АТФ-фосотрансферазы:
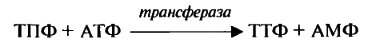
Основной коферментной формой (60—80 % от общего внутриклеточного) является ТПФ. ТТФ играет важную роль в метаболизме нервной ткани. При нарушении его образования развивается некротизирующая энцефалопатия. После распада коферментов свободный тиамин выделяется с мочой и определяется в виде тиохрома.
Витамин В, в форме ТПФ является составной частью ферментов, катализирующих реакции прямого и окислительного декарбоксилирования кетокислот.
Участие ТПФ в реакциях декарбоксилирования кетокислот объясняется необходимостью усиления отрицательного заряда углеродного атома карбонила кетокислоты в переходном, нестабильном, состоянии:
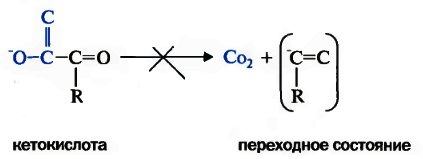
Переходное состояние стабилизируется ТПФ путем делокализаиии отрицательного заряда карбо-аниона тиазолового кольца, играющего роль своеобразного электронного стока. Вследствие такого протонирования образуется активный ацетальдегид (гидроксиэтил-ТПФ).
Аминокислотные остатки белков обладают слабой способностью осуществлять то, что с легкостью делает ТПФ, поэтому апобелки нуждаются в коферменте. ТПФ жестко связан с апоферментом мульти-ферментных комплексов дегидрогеназ а-оксикетокислот (см. ниже).
- Участие ТПФ в реакции прямого декарбоксилирования пировиноградной кислоты (ПВК).
При декарбоксилировании ПВК с помощью пируватдекарбоксилазы образуется ацетальдегид, который под воздействием алкогольдегидрогеназы превращается в этанол. ТПФ является незаменимым кофактором пируватдекарбоксилазы. Этим ферментом богаты дрожжи.
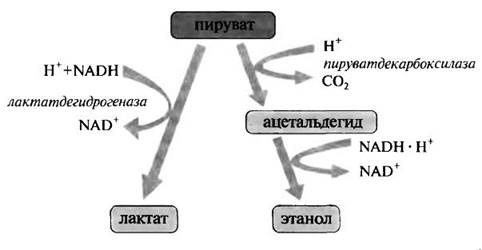
2. Участие ТПФ в реакциях окислительного декарбоксилирования.
Окислительное декарбоксилирование ПВК катализирует пируватде-гидрогеназа. В состав пируватдегидрогеназного комплекса входит несколько структурно связанных ферментных белков и коферментов (см. с. 100). ТПФ катализирует начальную реакцию декарбоксилирования ПВК. Эта реакция идентична катализируемой пируватдекарбоксила-зой. Однако в отличие от последней, пируватдегидрогеназа не превращает промежуточный продукт гидроксиэтил-ТПФ в ацетальдегид. Вместо этого гидроксиэтильная группа переносится к следующему ферменту в мультиферментной структуре пируватдегидрогеназного комплекса.
Окислительное декарбоксилирование ПВК является одной из ключевых реакций в обмене углеводов. В результате этой реакции ПВК, образовавшаяся при окислении глюкозы, включается в главный метаболический путь клетки — цикл Кребса, где окисляется до углекислоты и воды с выделением энергии. Таким образом, благодаря реакции окислительного декарбоксилирования ПВК создаются условия для полного окисления углеводов и утилизации всей заключенной в них энергии. Кроме того, образующаяся при действии ПДГ-комплек-са активная форма уксусной кислоты служит источником для синтеза многих биологических продуктов: жирных кислот, холестерина, стероидных гормонов, ацетоновых тел и других.
Окислительное дскарбоксилирование а-кетоглутатарата катализирует а-кетоглутаратдегидрогеназа. Этот фермент является составной частью цикла Кребса. Строение и механизм действия а-кетоглугарат-дегидрогеназного комплекса схожи с пируватдегидрогеназой, т. е. ТПФ также катализирует начальный этап превращения кетокислоты. Таким образом, от степени обеспеченности клетки ТПФ зависит бесперебойная работа этого цикла.
Помимо окислительных превращений ПВК и а-кетоглутарата, ТПФ принимает участие в окислительном декарбоксилировании кетокислот с разветвленным углеродным скелетом (продукты дезаминирования ва-лина, изолейцина и лейцина). Эти реакции играют важную роль в процессе утилизации аминокислот и, следовательно, белков клеткой.
3. ТПФ — кофермент транскетолазы.
Транскетолаза — фермент пентозофосфатного пути окисления углеводов. Физиологическая роль этого пути заключается в том, что он является основным поставщиком NADFH*H+ и рибозо-5-фосфата. Транскетолаза переносит дву-углеродные фрагменты от ксилулозо-5-фосфата к рибозо-5-фосфату,
что приводит к образованию триозофосфата (3-фосфоглицеринового альдегида) и 7С сахара (седогептулозо-7-фосфата). ТПФ необходим для стабилизации карб-аниона, образующегося при расщеплении связи С2-С3 ксилулозо-5-фосфата.
4. Витамин В1 принимает участие в синтезе ацетилхолина, катализируя в пируватдегидрогеназной реакции образование ацетил-КоА — субстрата ацетилирования холина.
5. Помимо участия в ферментативных реакциях, тиамин может выполнять и некоферментные функции, конкретный механизм которых еще нуждается в уточнении. Полагают, что тиамин участвует в кроветворении, на что указывает наличие врожденных тиаминзависимых анемий, поддающихся лечению высокими дозами этого витамина, а также в стероидогенезе. Последнее обстоятельство позволяет объяснить некоторые эффекты препаратов витамина В, как опосредованных стресс-реакцией.
Переходное состояние стабилизируется ТПФ путем дслокализаиии отрицательного заряда карб-аниона тиазолового кольца, играющего роль своеобразного электронного стока. Вследствие такого протонирования образуется активный ацетальдегид (гидроксиэтил-ТПФ).
Аминокислотные остатки белков обладают слабой способностью осуществлять то, что с легкостью делает ТПФ, поэтому апобелки нуждаются в коферменте. ТПФ жестко связан с апоферментом мульти-ферментных комплексов дегидрогеназ а-оксикетокислот (см. ниже).
 2015-06-26
2015-06-26 9730
9730