Как и другие белки, ферменты имеют первичную, вторичную, третичную и четвертичную структуры. Им присущи все физико-химические свойства белков, и лишь одна отличительная особенность у них – это способность катализировать химические реакции.
Все ферменты делятся на две большие группы – однокомпонентные и двухкомпонентные. Однокомпонентные ферменты состоят из одного белка, обладающего каталитическим действием. Двухкомпонентные состоят из белковой части – называемой апоферментом, и небелковой части, называемой кофактором. Оба компонента в отдельности лишены ферментативной активности.
Апофермент и кофактор образуют холофермент, т.е. функционально действенный энзим. Прочность связи между кофактором и апоферментом может быть различной. Если эта связь прочная и постоянная, то такой кофактор называют простетической группой. Если связывание белка и кофактора происходит в момент катализа, то такой кофактор называется коферментом.
Роль кофактора сводится либо к изменению трёхмерной структуры белка, способствующей лучшему связыванию фермента с субстратом, либо к непосредственному участию в реакции в качестве ещё одного субстрата. Соединение в холофермент осуществляется любыми типами связей, кроме ковалентных.
Роль кофактора выполняет какой-либо ион (Zn+2, Mg+2, Mn+2, Fe+2, Cu+2, K+, Na+) или органическое соединение, чаще всего производное витаминов.
Таблица 1 – Некоторые кофакторы
| Кофактор | Общая функция | Витамин-предшественник |
| NAD+, NADF+ | Перенос водорода (протонов и электронов) | Никотиновая кислота – витамин PP |
| FAD | Перенос водорода (протонов и электронов) | Рибофлавин – витамин B2 |
| Коэнзим А | Активация и перенос ацильных групп | Пантотеновая кислота – витамин B3 |
| Пиридоксальфосфат | Перенос аминогрупп | Пиридоксин – витамин B6 |
| Тиаминпирофосфат | Декарбоксилирование кетокислот | Тиамин – витамин B1 |
Как правило, именно коферменты выступают в качестве дополнительных субстратов. Они обычно играют роль промежуточных переносчиков, электронов или химических групп, которые в результате ферментативной реакции переносятся от одного соединения на другое.
Кофакторы термостабильны, тогда как белковая часть фермента денатурирует при нагревании. Кофактор ответственен за каталитическую активность фермента, белковая же часть усиливает каталитическое действие и определяет специфичность фермента. Один и тот же кофактор может функционировать в составе разных ферментов. Например, одна и таже NAD+ (никатинамидадениндинуклеотид) является коферментом многих дегидрогеназ (окислительно-восстановительных ферментов), отличие – в апоферментной части (белке).
При изучении взаимодействия фермента и субстрата было обращено внимание на то, что молекула фермента по размеру во много раз больше молекул субстрата. Это дало основание полагать, что субстрат взаимодействует не со всей молекулой фермента, а с каким-то небольшим участком, расположенным на его поверхности. Этот участок называется активным центром. Он находится в углублении поверхности белковой молекулы. У однокомпонентных ферментов активный центр образуется при формировании третичной структуры белка в результате сближения и определённой ориентации аминокислотных остатков, расположенных в различных концах полипептидной цепи. В двухкомпонентных ферментах активный центр представляет собой комплекс кофактора и нескольких примыкающих к нему аминокислотных остатков.
Чаще всего в активном центре содержатся остатки аминокислот гистидина, глутамина, аспарагина, цистеина, треонина. В активном центре фермента условно различают место, к которому прикрепляется субстрат – связующий или субстратный центр и каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом. Сказанное может быть представлено в следующей общей форме:
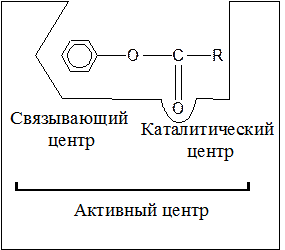
Рисунок 1 – Строение активного центра фермента
Структура активного центра комплементарна структуре его субстрата. Поэтому данный фермент из множества веществ находящихся в клетке, присоединяет только свой субстрат. У ферментов, имеющих четвертичную структуру, число активных центров может быть равно числу субъединиц.
 2015-06-26
2015-06-26 917
917








