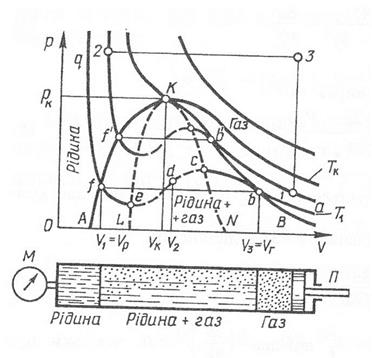
 Побудуємо ізотерми Ван-дер-ваальсівського газу для 1 моля. З рівняння Ван-дер-Ваальса отримаємо:
Побудуємо ізотерми Ван-дер-ваальсівського газу для 1 моля. З рівняння Ван-дер-Ваальса отримаємо:
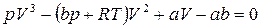
Графік функції, де параметром виступає температура, має вигляд:
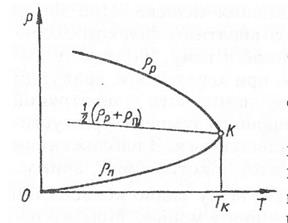 Рівняння Ван-дер-Ваальса описує не тільки газ, а й перехід газу до рідкого стану. Вперше такий хід ізотерм виявив при дослідженні аміака нідерландський вчений ван Марум. Він же виявив, що зріджувати гази можна лише за умови, що їх температура нижча від критичної. За спеціальних умов можна спостерігати нестабільні стани перегрітої рідини або пересиченої пари (якщо немає центрів конденсації), які легко переходять до газоподібного та рідкого станів. Температура, при якій зникають розбіжності між рідиною та її парою, називають критичною. В околі критичної точки спостерігається різка зміна термодинамічних властивостей речовини. Так незначна зміна тиску приводить до значної зміни об’’му, ізобарна теплоємність та стисливість прямують до нуля. Рівноважний стан поблизу критичної точки встановлюється повільно, отже всі явища переносу також сповільнюються.
Рівняння Ван-дер-Ваальса описує не тільки газ, а й перехід газу до рідкого стану. Вперше такий хід ізотерм виявив при дослідженні аміака нідерландський вчений ван Марум. Він же виявив, що зріджувати гази можна лише за умови, що їх температура нижча від критичної. За спеціальних умов можна спостерігати нестабільні стани перегрітої рідини або пересиченої пари (якщо немає центрів конденсації), які легко переходять до газоподібного та рідкого станів. Температура, при якій зникають розбіжності між рідиною та її парою, називають критичною. В околі критичної точки спостерігається різка зміна термодинамічних властивостей речовини. Так незначна зміна тиску приводить до значної зміни об’’му, ізобарна теплоємність та стисливість прямують до нуля. Рівноважний стан поблизу критичної точки встановлюється повільно, отже всі явища переносу також сповільнюються.
|
|
|
Контрольні питання
1. Дайте визначення та вкажіть відомі вам явища переносу.
2. Вкажіть зв’язок явищ переносу з градієнтом величини.
3. Дайте визначення ефективному діаметру, сфері молекулярної дії,та довжині вільного пробігу молекули.
4. Вкажіть зв’язок між коефіцієнтами в’язкостіґ теплопровідності та дифузії, їх залежність від концентрації та тепрератури середовища.
5. Чому не співпадають ізотерми ідеального та реальних газів?
6. Що характеризують поправки Ван-дер-Ваальса? Запишіть рівняння Ван-дер-Ваальса для довільної маси газу.
7. Вкажіть на ізотермах Ван-дер-Ваальса двофазні області, область перегрітої рідини та пересиченої пари.
8. Що таке «критичний стан», «критична температура»?
9. Запишіть вираз для внутрішньої енергії реальних газів. Чим він відрізняється від виразу для ідеального газу?
10. Чи завжди можливе зжиження газу? Чому?.
 2015-06-26
2015-06-26 749
749







