Частным случаем трехкомпонентных систем являются водные растворы двух солей с одноименными ионами. Если у двух растворенных солей нет такого иона, то система является уже не трех-, а четырехкомпонентной, так как в нее входят пять индивидуальных веществ: вода и четыре соли, участвующие в обменной реакции, приводящей к равновесию:
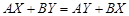 .
.
В этом случае число компонентов системы, равное разности между числом индивидуальных веществ системы и числом уравнений, 5 – 1 = 4. Две соли с общим ионом не реагируют между собой, и система из двух солей и воды является трехкомпонентной.
При изучении последовательности кристаллизации этих солей при изотермическом испарении растворителя из раствора можно также использовать треугольные диаграммы состояния Гиббса (рис. 60-а) или диаграммы Шрайнемакерса в прямоугольной системе координат (рис. 60-б).
В последнем случае начало координат соответствует чистому растворителю. По осям откладываются в заданном масштабе концентрации каждой из солей, выраженные любым способом (грамм на 100 г воды, моль на 100 моль воды и др.), а также точки, соответствующие растворимости данной соли при данной температуре. Затем при построении диаграммы изучают изменение растворимости каждой из солей при совместном их присутствии в растворе в различных количествах. Полученные данные наносят на диаграмму.
Располагая такой диаграммой, можно определить состав ненасыщенных растворов, состав кристаллов, образующихся из сложного раствора данного состава, изменение состава раствора по мере кристаллизации солей, влияние температуры на последовательность кристаллизации и состав твердых фаз, а также зафиксировать образование в системе двойных солей или кристаллогидратов.
 2015-07-04
2015-07-04 437
437








