Аналогичная неравномерность имеет место и в распределении частиц в газе по скоростям. Случайный обмен импульсами и энергиями частиц при столкновениях приводит к некоторому разбросу кинетических энергий и скоростей молекул вокруг их средних значений, соответствующих установившейся в газе температуре. Случайные изменения скоростей молекул в результате столкновений можно рассматривать как случайное блуждание частиц, но не в реальном координатном пространстве, а в пространстве скоростей, осями в котором являются скорости частиц vx, vу, vz (рис.).
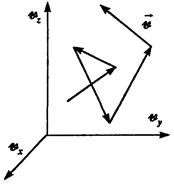 Поэтому все сказанное о хаотическом тепловом движении в реальном пространстве применимо и к распределению частиц по скоростям.
Поэтому все сказанное о хаотическом тепловом движении в реальном пространстве применимо и к распределению частиц по скоростям.
Наиболее вероятная величина скорости в газе — скорость vm.
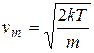 .
.
Средняя скорость: 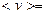
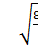
Cреднеквадратичной скорости:
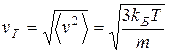
Все эти средние скорости близки друг другу.
 2015-07-03
2015-07-03 159
159






