В силу второго начала термодинамики, энтропия 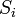 замкнутой системы не может уменьшаться" (закон неубывания энтропии). Математически это можно записать так:
замкнутой системы не может уменьшаться" (закон неубывания энтропии). Математически это можно записать так: 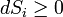 , индекс
, индекс 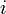 обозначает так называемую внутреннюю энтропию, соответствующую замкнутой системе. В открытой системе возможны потоки тепла как из системы, так и внутрь неё. В случае наличия потока тепла в систему приходит количество тепла
обозначает так называемую внутреннюю энтропию, соответствующую замкнутой системе. В открытой системе возможны потоки тепла как из системы, так и внутрь неё. В случае наличия потока тепла в систему приходит количество тепла 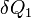 при температуре
при температуре 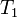 и уходит количество тепла
и уходит количество тепла 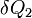 при температуре
при температуре 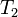 . Приращение энтропии, связанное с данными тепловыми потоками, равно:
. Приращение энтропии, связанное с данными тепловыми потоками, равно:
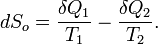
В стационарных системах обычно 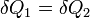 ,
, 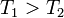 , так что
, так что 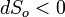 . Поскольку здесь изменение энтропии отрицательно, то часто употребляют выражение «приток негэнтропии», вместо оттока энтропии из системы. Негэнтропия определяется таким образом как "отрицательная энтропия".
. Поскольку здесь изменение энтропии отрицательно, то часто употребляют выражение «приток негэнтропии», вместо оттока энтропии из системы. Негэнтропия определяется таким образом как "отрицательная энтропия".
Суммарное изменение энтропии открытой системы будет равно:
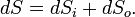
Если всё время 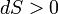 , то рост внутренней энтропии не компенсируется притоком внешней негэнтропии, система движется к ближайшему состоянию равновесия. Если
, то рост внутренней энтропии не компенсируется притоком внешней негэнтропии, система движется к ближайшему состоянию равновесия. Если 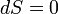 , то мы имеем стационарный процесс с неизменной общей энтропией. В этом случае в системе осуществляется некоторая внутренняя работа с генерацией внутренней энтропии, которая преобразует, например, температуру
, то мы имеем стационарный процесс с неизменной общей энтропией. В этом случае в системе осуществляется некоторая внутренняя работа с генерацией внутренней энтропии, которая преобразует, например, температуру 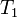 внешнего потока тепла в температуру
внешнего потока тепла в температуру 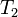 уходящего из системы потока тепла.
уходящего из системы потока тепла.
В реальных экспериментах очень трудно измерить энтропию системы. Техники измерения базируются на термодинамическом определении энтропии и требуют экстремально аккуратной калориметрии.
Для упрощения мы будем исследовать механическую систему, термодинамические состояния которой будут определены через её объем V и давление P. Для измерения энтропии определенного состояния мы должны сперва измерить теплоёмкость при постоянных объёме и давлении (обозначенную CV и CP соответственно), для успешного набора состояний между первоначальным состоянием и требуемым. Тепловые ёмкости связаны с энтропией S и с температурой T согласно формуле:
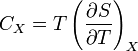
где нижний индекс X относится к постоянным объёму и давлению. Мы можем проинтегрировать для получения изменения энтропии:
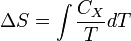
Таким образом, мы можем получить значение энтропии любого состояния (P, V) по отношению к первоначальному состоянию (P0, V0). Точная формула зависит от нашего выбора промежуточных состояний. Для примера, если первоначальное состояние имеет такое же давление, как и конечное состояние, то
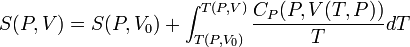
В добавление, если путь между первым и последним состояниями лежит сквозь любой фазовый переход первого рода, скрытая теплота, ассоциированная с переходом, должна также учитываться.
Энтропия первоначального состояния должна быть определена независимо. В идеальном варианте выбирается первоначальное состояние как состояние при экстремально высокой температуре, при которой система существует в виде газа. Энтропия в этом состоянии подобна энтропии классического идеального газа плюс взнос от молекулярных вращений и колебаний, которые могут быть определены спектроскопически.
Следующее уравнение может быть использовано для построения графика изменения энтропии на диаграмме P—V:
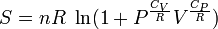
Но предполагается, что 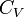 и
и 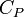 постоянные, что на самом деле не так.
постоянные, что на самом деле не так.
 2015-07-03
2015-07-03 2414
2414