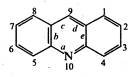
 Акридин (дибензо[6,е]піридин) є конденсованою системою, яка вміщує два бензольні і одне піридинове кільце. Нумерують атоми акридинового ядра як показано на структурній формулі. Найбільший номер дістає гетероатом. Акридин відкрили в 1870 р. німецькі хіміки-органіки К.Гребе та Г.Каро, котрі першими виділили його з кам'яновугільної смоли.
Акридин (дибензо[6,е]піридин) є конденсованою системою, яка вміщує два бензольні і одне піридинове кільце. Нумерують атоми акридинового ядра як показано на структурній формулі. Найбільший номер дістає гетероатом. Акридин відкрили в 1870 р. німецькі хіміки-органіки К.Гребе та Г.Каро, котрі першими виділили його з кам'яновугільної смоли.
А. Способи добування
Незважаючи на те, що він міститься в кам'яновугільній смолі, частіше акридин і його похідні добувають синтетично.
1.Конденсація дифеніламіну з карбоновими кислотами (Бернтсен, 1884 p.). При нагріванні дифеніламіну з мурашиною кислотою в присутності хлориду цинку утворюється акридин, конденсація з іншими карбоновими кислотами дає 9-R-заміщені акридини.
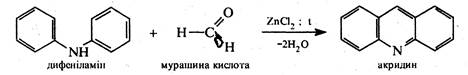
2. Циклізація N-фенілантранілової кислоти. В1933 р. вітчизняні вчені О.Ю.Магідсон і А.М.Григоровський запропонували способ добування акридину та його похідних, оснований на циклізації N-фенілантранілової кислоти за допомогою трихлороксиду фосфору (РОС13). Реакція проходить через стадію утворення хлорангідриду N-фенілантранілової кислоти та 9-гідроксіакридину. Кінцевим продуктом є 9-хлоракридин.
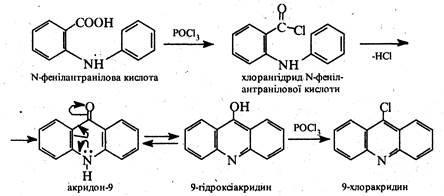
В молекулі 9-хлоракридину атом хлору виявляє значну рухливість і може бути легко заміщений на атом водню, алкокси-, аміно- або гідроксигрупу.
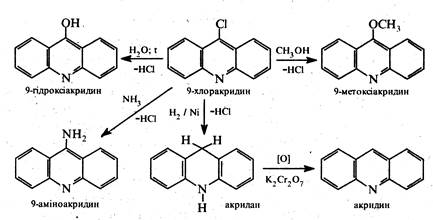
Для добування різних похідних акридину з замісниками в бензольних ядрах циклізації піддають відповідні заміщені N-фенілантранілові кислоти.
Б. Фізичні властивості
Акридин — світло-жовта кристалічна речовина (т. пл. 111°С) з характерним запахом, легко возганяється, викликає подразнення шкіри та дихальних шляхів, звідки й походить його назва (лат. acris -«їдкий»). Він добре розчинний в етанолі, діетиловому ефірі та бензолі, малорозчинний у воді. Розбавлені розчини мають синю флуоресценцію.
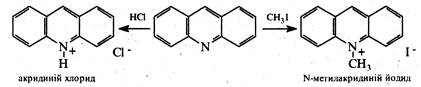
Акридин є ароматичною сполукою. За участю неподіленої пари електронів атома азоту він виявляє слабкі основні властивості та утворює солі з сильними кислотами і алкілгалогенідами:
В реакції електрофільного заміщення акридин вступає насилу і неоднозначно. Так, при нітруванні утворюється суміш ізомерних нітроакридинів зі вмістом переважно 2-нітроакридину.
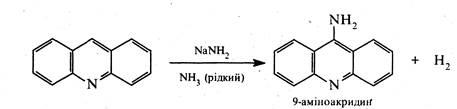
Реакції нуклеофільного заміщення для акридину ідуть доволі легко за положенням 9. Наприклад, при дії на акридин амідом натрію утворюється 9-аміноакридин.
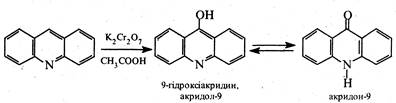
Акридинове ядро вельми стійке до окиснення. Під дією дихромату калію в оцтовокислому середовищі акридин окиснюеться в акридон-9, який є таутомерною сполукою та існує у двох формах гідрокси- та оксоформі.
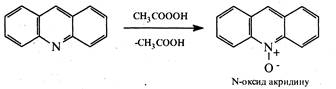
У присутності органічних пероксикислот акридин окиснюється по гетероатому з утворенням N-оксиду.
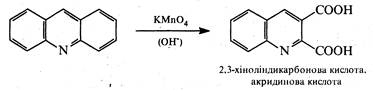
При окисненні за жорстких умов (KМnО4 в лужному середовищі) відбувається часткове руйнування акрйдинового ядра, а продуктом окислення є 2,3-хіноліндикарбонова кислота (акридинова кислота):
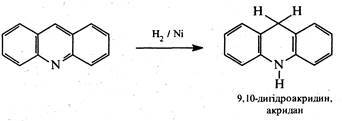
Відновлення акридину відбувається аналогічно антрацену, тобто за положеннями 9 і 10. Так, під дією натрію в спиртовому розчині або при каталітичному гідруванні акридин перетворюється на 9,10-дигідроакридин (акридан).
Г. Найважливіші похідні акридину
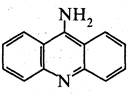 9-Аміноакридин — жовта кристалічна речовина (т. пл. 236-237 °С), розчинна в етанолі та ацетоні.
9-Аміноакридин — жовта кристалічна речовина (т. пл. 236-237 °С), розчинна в етанолі та ацетоні.
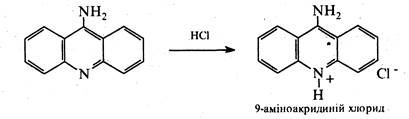
9-Аміноакридин — сильніша основа, ніж акридин. Він містить у своєму складі два основні центри — атом азоту піридинового типу і атом азоту аміногрупи. Проте, внаслідок спряження аміногрупи з гетероатомом, 9-аміноакридин, аналогічно γ-амінопіридину, утворює сіль тільки ііо кільцевому азоту.
Деякі похідні 9-аміноакридину застосовуються як лікарські препарати, наприклад, акрихін і етакридину лактат (риванол).
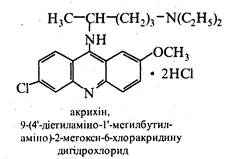
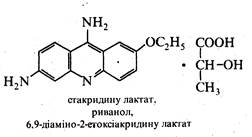
Акрихін виявляє протималярійну, а етакридину лактат – антисептичну дію.
 2015-07-14
2015-07-14 2948
2948








