Все многообразие буровых растворов рассматривается в специальной литературе. Из-за незначительного объема курса рассматрим только пресный глинистый раствор. Его состав можно записать в виде формулы:
глинистый раствор = вода + глина + химические реагенты.
Вода является дисперсионной средой, а глина дисперсной фазой. По сути глинистый раствор представляет собой коллоидную суспензию.
Глинистые минералы представляют собой водные алюмосиликаты. Например, молекула минерала монтмориллонита имеет химическую формулу Al2(Si4O10)OH·nH2O. Глинистые минералы имеют форму пластинок. Если бы минерал имел идеальный химический состав, то никакого раствора из него не получилось бы. Глинистые минералы образуются в водной среде и взаимодействуют с насыщающими ее солями, вступая в реакции замещения ионов Al+3 и Si+4 на ионы щелочных и щелочно-земельных металлов по схемам:
Al+3 → Ca+2 + Na+1 (или Ка+1);
Al+3 → Мg+2 + Na+1 (или Ка+1);
Si+4 → Mg+2 + Ca+2;
Si+4 → Al+3 + Na+1 (или Ка+1).
Кристаллическая решетка глинистых минералов плотно упакована, и на месте замещенных ионов помещаются только ионы первого слагаемого схемы. Ионы второго слагаемого располагаются на поверхности глинистой пластинки, имеют с ней ослабленную связь и могут вступать в обменные реакции и диссоциировать в воде. Поэтому эти ионы получили название ионы обменного комплекса. При взаимодействии пластинки с водой она как бы диссоциирует, отдавая ионы обменного комплекса в воду. Такое взаимодействие обусловливает особое коллоидное состояние глины и физико-химическую природу сил связи между ее частицами. На рис. 5.1 приведена схема "диссоциации" глинистых частиц и их взаимодействий.
|
|
|

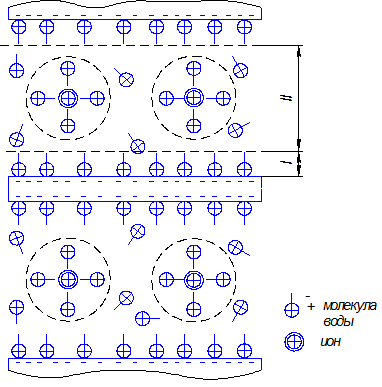 Между глинистыми частицами находятся два слоя воды. Отдав в воду ионы обменного комплекса, глинистая частица приобретает отрицательный заряд. Вода - жидкость полярная, т.е. один конец молекулы воды заряжен положительно, а другой - отрицательно. Глинистые частицы притягивают молекулы воды, и на их поверхности образуется пленка (первый слой) физически связанной воды (гидратная оболочка), которая имеет внешний отрицательный заряд. Катионы во втором слое воды, называемом диффузным, также окружены ассоциациями молекул воды (на рис. 5.1 показаны пунктиром), имеющими внешний положительный заряд. Взаимодействие этих зарядов обусловливает связность глинистых частиц. В зависимости от толщины диффузного слоя глина может быть в твердом, пластичном и текучем состоянии.
Между глинистыми частицами находятся два слоя воды. Отдав в воду ионы обменного комплекса, глинистая частица приобретает отрицательный заряд. Вода - жидкость полярная, т.е. один конец молекулы воды заряжен положительно, а другой - отрицательно. Глинистые частицы притягивают молекулы воды, и на их поверхности образуется пленка (первый слой) физически связанной воды (гидратная оболочка), которая имеет внешний отрицательный заряд. Катионы во втором слое воды, называемом диффузным, также окружены ассоциациями молекул воды (на рис. 5.1 показаны пунктиром), имеющими внешний положительный заряд. Взаимодействие этих зарядов обусловливает связность глинистых частиц. В зависимости от толщины диффузного слоя глина может быть в твердом, пластичном и текучем состоянии.
При приготовлении глинистого раствора производится диспергирование глинистых частиц в большом количестве воды, а поэтому силы притяжения между частицами становятся незначительными. Но частицы не выпадают в осадок, так как отрицательный заряд на поверхности их гидратных оболочек заставляет их распределиться равномерно в объеме раствора.
|
|
|
Тиксотропия раствора - это его способность образовывать структуру (превращаться в гель) в покое и вновь разжижаться при перемешивании. В покое глинистые частицы совершают броуново движение в растворе и сталкиваются между собой. Но сталкиваться они могут только торцами пластинок, на которых толщина гидратной оболочки незначительна. Частицы как бы слипаются, а гидратные оболочки становятся продолжением одна другой. В результате образуется ячеистая структура, а раствор приобретает некоторые свойства твердого тела. Такая структура удерживает во взвешенном состоянии частицы значительных размеров, например, если раствор находится в покое, то в нем не тонет шлам.
Коагуляция раствора - происходит при утрате частицами глины отрицательного заряда. В результате разрушается гидратная оболочка, а глинисты частицы слипаются и выпадают в осадок. Например, такое явление наблюдается при попадании большого количества пластовой высоко- минерализованной воды в глинистый раствор.
 2015-07-21
2015-07-21 1910
1910








