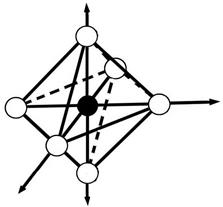
Между комплексообразователем и лигандами -ковалентные связи, образованные по донорно-акцепторному механизму.
 донор – лиганд (поставщик пары электронов ↑↓) акцептор – комплексообразователь (наличие свободных АО)
донор – лиганд (поставщик пары электронов ↑↓) акцептор – комплексообразователь (наличие свободных АО)

Атом Аl (р -элемент) … 3 s 23 р 1
Комплексообразователь Al3+:



 3 s 03 p 0
3 s 03 p 0


 :Br-:Br-:Br-:Br-
:Br-:Br-:Br-:Br-
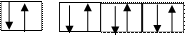 |
sp 3-гибридизация орбиталей.
Строение комплексного иона - тетраэдр

| |||
 |
|
в противном случае - лиганд слабого поля.

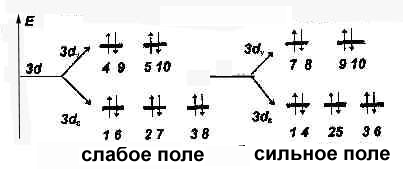
Для 3 d -элементов - (в порядке возрастания силы поля):
|
|
|
|
Однако границы между сильным и слабым полями лигандов провести сложно, например:
[MnF6]2- лиганд F- - слабое поле,
[NiF6]2- лиганд F- - сильное поле.

Атом Fe (d -элемент) … 3 d 64 s 2
Комплексообразователь Fe3+: 3 d 54 s 0
Лиганды CN- - лиганды сильного поля,
|



Fe+3
3 d 4 s 4 p
d2sp3 -гибридизация орбиталей
структура комплекса - октаэдр
 | |||
 |
· Лиганды располагаются вокруг комплексообразователя так, чтобы силы притяжения были максимальны, а силы отталкивания минимальны.
· Лиганды влияют на энергетическое состояние d- электронов комплексообразователя.
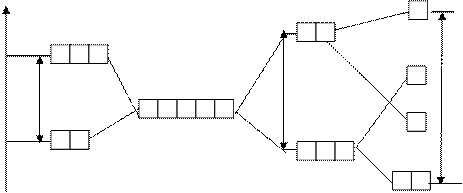
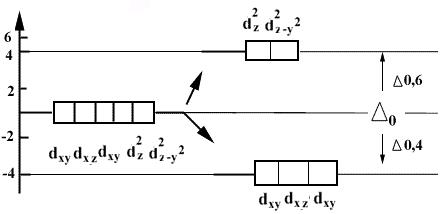
В отсутствии внешнего электростатического поля все d -орбитали - вырожденные.

D - зависит от к.ч., природы лигандов и комплексообразователя (учебник, стр.78)
плоский квадрат
 |
октаэдр
тетраэдр
de dg
Dтетр Dокт Dквадр.пл.
dg (n- 1) d -орбитали de
свободного иона
комплексообразователя
 | |||
 |
 |
Распределение электронов на (n -1) d -орбиталях:
(зависит от силы поля лиганда)
 |
● В образовании химической связи участвуют:
(n -1) d g-, n s -, n p - и n d - орбитали.

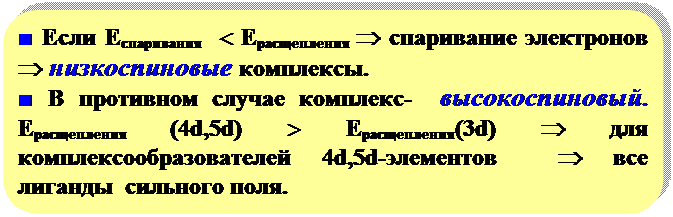
■ комплексообразовательСо2+: 3 d 74 s 0
■ К.ч. 6 Þ октаэдрическое расщепление
■ центральный атом – 3 d – элемент Þ сила поля лиганда по спектрохимическому ряду:
Н2О – лиганд среднего поля, а для Со2+ (низшая степень окисления) он относится к слабым.
:н2о:н2о:н2о:н2:н2о:н2о









 Е
Е

3 dg 4 s 4 p 4 d
 |


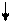
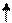
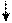
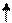
 3 de
3 de
● sp 3 d 2-гибридизация
● структура комплекса [Со(Н2О)6]2+ - октаэдр
● комплекс – высокоспиновый,
|
|
|
внешнеорбитальный (т.к. взаимодействует внешний d - подуровень).
 2015-07-14
2015-07-14 1145
1145