Для записи условия равновесия системы, состоящей из твёрдых тел, систему разделяют на отдельные части, и записывают уравнения равновесия как для всей системы, так и для её частей[1]. При этом возможны несколько эквивалентных вариантов записи условий равновесия в зависимости от выбора частей системы, для которых записываются уравнения.
Из второго закона Ньютона следует, что если геометрическая сумма всех внешних сил, приложенных к телу, равна нулю, то тело находится в состоянии покоя или совершает равномерное прямолинейное движение. В этом случае принято говорить, что силы, приложенные к телу, уравновешивают друг друга. При вычислении равнодействующей все силы, действующие на тело, можно прикладывать к центру масс.
Чтобы не вращающееся тело находилось в равновесии, необходимо, чтобы равнодействующая всех сил, приложенных к телу, была равна нулю.
16. Молекулярно - атомное строение вещества. Основные положения молекулярно-кинетической теории (МКТ), явления и опыты, подтверждающие МКТ.
|
|
|
Атомно-молекулярное учение — совокупность теоретических представлений естествознания о дискретном строении веществ.
В развитие атомно-молекулярного учения большой вклад внесли М. В. Ломоносов, Дж. Дальтон, А. Лавуазье, Ж. Пруст, А. Авогадро, Й. Берцелиус, Д. И. Менделеев, А. М. Бутлеров.
Молекулярно-кинетическая теория (сокращённо МКТ) — теория, возникшая в XIX веке и рассматривающая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
· все тела состоят из частиц: атомов и молекул;
· частицы находятся в непрерывном хаотичном движении (тепловом);
· частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.
МКТ стала одной из самых успешных физических теорий и была подтверждена целым рядом опытных фактов. Основными доказательствами положений МКТ стали:
· Диффузия
· Броуновское движение
· Изменение агрегатных состояний вещества
На основе МКТ развит целый ряд разделов современной физики, в частности, физическая кинетика и статистическая механика. В этих разделах физики изучаются не только молекулярные (атомные или ионные) системы, находящиеся не только в «тепловом» движении, и взаимодействующие не только через абсолютно упругие столкновения. Термин же молекулярно-кинетическая теория в современной теоретической физике уже практически не используется, хотя он встречается в учебниках по курсу общей физики.
17. Единица атомной массы. Относительная атомная масса и относительная молекулярная масса. Количество вещества. Моль вещества. Число Авогадро. Молярная масса.
|
|
|
А́томная едини́ца ма́ссы (русское обозначение: а. е. м.; международное: u), она же дальто́н (обозначение Da), она же углеродная единица [1] — внесистемная единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц. Атомная единица массы выражается через массу нуклида углерода12C и равна 1/12 массы этого нуклида.
Относительной атомной массой химического элемента называется величина, показывающая во сколько раз масса данного атома больше 1/12 массы атома углерода. Она обозначается буквой Аr. Относительные атомные массы указаны в периодической таблице. Например Аr(Н)=1, Аr(Р)=31. Атомные массы округляем до целых величин, исключая атом хлора- Аr(Cl)=35,5
Относительной молекулярной массой вещества называется величина, покаывающая во сколько раз масса молекулы больше 1/12 массы атома углерода. Она обозначается Мr. Вы знаете, что молекулы состоят из атомов, поэтому относительная молекулярная масса складывается из суммы атомных масс атомов, составляющих молекулу,с учётом числа атомов. Например Мr(H2SO4)=1·2+32+16·4=98.
Введём ещё одну величину - количество вещества, которое измеряется в молях.
Моль-это количество вещества, содержащее столько структурных единиц(атомов, молекул, ионов), сколько атомов содержится в 12 г углерода. Обозначается буквой ν (ню)
Зная массу атома углерода 1,993·10-26 кг можно вычислить число атомов в 0,012 кг углерода:
NA=0,012/1,993·10-26=6,02·1023
Это число называется постоянной Авогодро и обозначается NA, размерность 1/моль или моль -1,и показывает число структурных единиц в моле любого вещества. Т.е. 1 моль любого вещества содержит одинаковое число структурных единиц 6,02·1023. Используя эту величину можноопределить количество вещества по формуле:
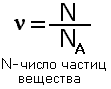
С числом частиц работать трудно, поэтому вводится понятие молярная масса, которая показывает чему равна масса 1 моль конкретного вещества. Молярная масса равна отношению массы вещества к количеству вещества, обозначается буквой М.
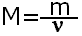
Молярная масса рассчитывается так же как и относительная молекулярная масса, но в отличии от неё имеет размерность г/моль. Например М(H2SO4)=1·2+32+16·4=98г/моль.Это означает, что масса 1 моль серной кислоты равна 98 г.
Ещё интересно то, что один моль любого газообразного вещества занимает объём 22,4 литра. Эта закономерность была установлена итальянским учёным Амадео Авргадро. Для газов можно использовать величину молярный объём, который обозначается буквой Vm, Vm=22.4 моль/л.
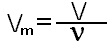
где V-объём газа в л.
18. Идеальный газ. Законы идеального газа.
Идеальный газ — математическая модель газа, в которой в рамках молекулярно-кинетической теории предполагается, что: 1)потенциальной энергией взаимодействия частиц, составляющих газ, можно пренебречь по сравнению с их кинетической энергией; 2) суммарный объём частиц газа пренебрежимо мал; 3) между частицами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги; 4) время взаимодействия между частицами пренебрежимо мало по сравнению со средним временем между столкновениями. В расширенной модели идеального газа частицы, из которого он состоит, имеют форму упругих сфер или эллипсоидов, что позволяет учитывать энергию не только поступательного, но и вращательно-колебательного движения, а также не только центральные, но и нецентральные столкновения частиц[1]. В рамках термодинамикиидеальным называется газ, подчиняющийся термическому уравнению состояния Клапейрона — Менделеева.
Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля:
При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const.
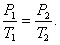

|
|
|
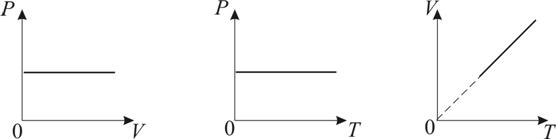
Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака:
При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
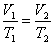 . . 
|
Изотермический процесс. Закон Бойля – Мариотта. T = const.
Изотермическим процессом называется процесс, протекающий при постоянной температуре Т. 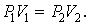
Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const. 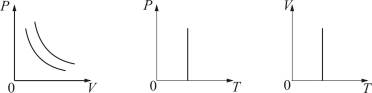
19. Уравнение Менделеева-Клапейрона. Законы Авогадро и Дальтона.
уравнениеМенделеева — Клапейрона) — формула, устанавливающая зависимость между давлением,молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
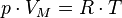 ,
,
где
· 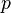 — давление,
— давление,
· 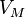 — молярный объём,
— молярный объём,
· 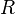 — универсальная газовая постоянная
— универсальная газовая постоянная
· 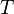 — абсолютная температура, К.
— абсолютная температура, К.
Так как 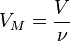 , где
, где 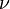 — количество вещества, а
— количество вещества, а 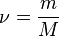 , где
, где 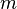 — масса,
— масса, 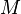 — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать:
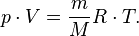
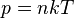 где
где 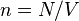 - концентрация атомов,
- концентрация атомов, 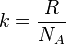 - постоянная Больцмана.
- постоянная Больцмана.
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
Уравнение, выведенное Клапейроном, содержало некую неуниверсальную газовую постоянную  , значение которой необходимо было измерять для каждого газа:
, значение которой необходимо было измерять для каждого газа:
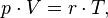
Менделеев же обнаружил, что  прямо пропорциональна
прямо пропорциональна 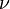 , коэффициент пропорциональности
, коэффициент пропорциональности 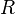 он назвал универсальной газовой постоянной.
он назвал универсальной газовой постоянной.
Закон Авогадро. При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится одинаковое число молекул. В одном моле различных веществ содержится NA =6,02·1023 молекул (число Авогадро).
7. Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов:
|
|
|
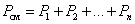
| (1.4.6) |
Парциальное давление Pn – давление, которое оказывал бы данный газ, если бы он один занимал весь объем.
Объединённый газовый закон (Закон Клапейрона).
В соответствии с законами Бойля – Мариотта (1.4.5) и Гей-Люссака (1.4.3) можно сделать заключение, что для данной массы газа
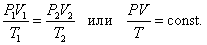
|
20. 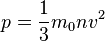 . Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) термодинамической системы с микроскопическими (масса молекул, средняя скорость их движения).
. Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) термодинамической системы с микроскопическими (масса молекул, средняя скорость их движения).
Упрощенный вывод основного уравнения МКТ[править | править вики-текст]
Пусть имеется 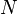 частиц массой
частиц массой 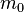 в некотором кубическом сосуде.
в некотором кубическом сосуде.
Так как молекулы движутся хаотически, то события, состоящие в движении в одном из шести независимых направлений пространства, совпадающих с осями декартовой системы координат, равновероятны.
Поэтому, в каждом из этих направлении движется 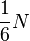 частиц.
частиц.
Пусть все частицы обладают одинаковой скоростью 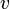 .
.
Каждая из частиц, сталкивающихся со стенкой, передаёт ей импульс 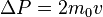 .
.
Если площадь стенки 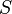 , а концентрация -
, а концентрация - 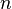 , то количество частиц, сталкивающихся со стенкой за время
, то количество частиц, сталкивающихся со стенкой за время 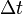 равно
равно 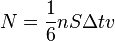 .
.
Так как 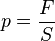 , а
, а 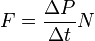 - суммарная сила взаимодействия частиц со стенкой, то подставив соответствующие значения получим
- суммарная сила взаимодействия частиц со стенкой, то подставив соответствующие значения получим 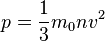 ,
,
так как 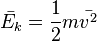 , то
, то 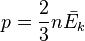
 2015-07-14
2015-07-14 485
485






