В 1888 г. Ф. Оствальд применил к рассмотрению диссоциации электролитов закон действующих масс (см. гл. 7). Таким образом он вывел соотношение между константой равновесия и степенью диссоциации электролита. Это соотношение получило название закона разбавления Оствальда. Вывод закона Оствальда основан на рассмотрении диссоциации слабого электролита. Допустим, что при растворении электролита BA в воде образуется раствор, имеющий концентрацию с. В результате некоторая часть а электролита BA диссоциирует, образуя ионы B+ и А-. Величина а называется степенью диссоциации. Равновесная концентрация неионизированного электролита BA оказывается равной с (I — а). Таким образом, можно записать
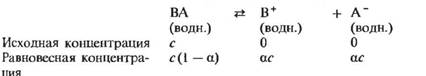
Запишем теперь выражение для константы равновесия рассматриваемой диссоциации
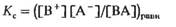
Подставив в это выражение равновесные концентрации участников диссоциации, получим
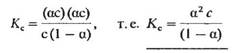
Это соотношение и представляет собой закон разбавления Оствальд а. Константа Кс называется константой диссоциации электролита. Чем больше Кс, тем сильнее электролит.
 2015-08-12
2015-08-12 7287
7287






