1. Зволожити водою тканину 2 першого термометра.
2. Ключ 5 вентилятора психрометра повернути за годинниковою стрілкою на п’ять–шість обертів і спостерігати за показами сухого і вологого термометрів. Коли настане термодинамічна рівновага, записати ці покази в таблицю.
3. Повторити експеримент ще двічі через 8–10 хв. Отримані значення t° B і t°C усереднити. Розрахувати D t°=t°C – t° B.
4. За отриманими в експерименті значеннями D t° і t°C обчислити відносну вологість повітря f. Шукане значення f визначають на перетині горизонтального рядка психрометричної таблиці, який відповідає t°C, і вертикального стовпця, який відповідає D t°.
5. За таблицею „Тиск і густина насиченої водяної пари при різних температурах” визначити P H і P HB, які відповідають температурам t°C і t° B. Визначити атмосферний тиск P 0 за показами барометра. Результати записати в таблицю:
| Номер за пор. | t °C, °C | D t °C,°C | t° B, °C | D t° B,°C | P H, мм. рт.ст | D P H, мм. рт.ст | P HB, мм. рт.ст | D P HB, мм. рт.ст | f, % | D f, % |
| …. | ||||||||||
| C.з. |
6. Розрахувати за формулою (4) тиск водяної пари в повітрі за умов виконаного експерименту (аналог абсолютної вологості).
7. Обчислити за формулою (2) сталу психрометра a.
8. Похибки D P H, D P HB і D f обчислити за середнім арифметичним кількості вимірювань, а D P 0 – як похибку приладу.
9. Абсолютні похибки вимірювань обчислити за формулами
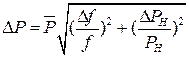 ;
;
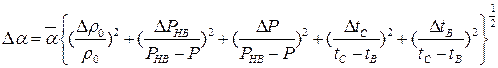 .
.
10. Записати кінцевий результат експерименту у вигляді
f =` f ± D f, Ef =…%;
a =` a ±D a, Ea =…%;
P =` P ± D P, EP =…%.
Контрольні запитання
1. Яку пару називають насиченою і як залежить її тиск від температури рідини?
2. Дайте означення абсолютної і відносної вологості повітря.
3. Що таке точка роси?
4. Яке рівняння описує стан насиченої пари? Запишіть його.
5. Як змінюється внутрішня енергія рідини в процесі випаровування?
6. Які чинники впливають на різницю показів сухого і вологого термометрів?
7. Від чого залежить швидкість випаровування рідини? Чому покази сухого термометра більші, ніж покази вологого? Чи завжди виконується це співвідношення?
Лабораторна робота № 215. ДОСЛІДЖЕННЯ КРИТИЧНОГО СТАНУ РЕЧОВИНИ
Завдання: визначити критичну температуру ефіру.
Приладдя: установка для дослідження критичного стану речовини ампула з ефіром.
Теоретичний матеріал, який необхідно засвоїти під час підготовки до виконання роботи: ідеальний і реальний гази; рівняння Ван-дер-Ваальса; ізотерми ідеального та реального газів, метастабільні стани; критичний стан речовини, критичні параметри та їхнє виведення з рівняння стану; зрідження газів; фазові переходи.
Література:
1) § 17.1–17.3, с. 326–336; § 17.5, c. 341–344;
2) § 17.2–17.5, c. 56–62;
3) § 64–66, с. 203–210.
4) § 60–65, с. 103–111.
 Опис установки. Установка для дослідження критичного стану речовини (рис. 17) складається з електричного нагрівника 1, призначеного для нагрі-вання ампули з ефіром 4, який живиться напругою 220 В через вимикач 6. Ам-пула
Опис установки. Установка для дослідження критичного стану речовини (рис. 17) складається з електричного нагрівника 1, призначеного для нагрі-вання ампули з ефіром 4, який живиться напругою 220 В через вимикач 6. Ам-пула 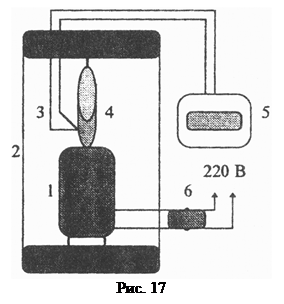 розміщена безпосередньо над нагрівником і перебуває в контакті зі спаєм термопари 3. Термопара 3 разом із потенціометром 5 утворюють елек-тричний термометр, який вимірює температуру ампули 4. Під час повільного нагрівання температура ампули з достатньою точністю відповідає температурі ефіру. Ампула з ефіром, нагрівник і термопара розміщені в захисному корпусі 2.
розміщена безпосередньо над нагрівником і перебуває в контакті зі спаєм термопари 3. Термопара 3 разом із потенціометром 5 утворюють елек-тричний термометр, який вимірює температуру ампули 4. Під час повільного нагрівання температура ампули з достатньою точністю відповідає температурі ефіру. Ампула з ефіром, нагрівник і термопара розміщені в захисному корпусі 2.
Ідея роботи та виведення робочої формули. Теоретичною основою дослідження критичного стану речовини є рівняння стану реального газу – рівняння Ван-дер-Ваальса. Для одного моля (кіломоля) реального газу це рівняння записують так:
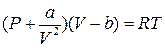 , (1)
, (1)
де P, V i Т – відповідно, тиск, об’єм і температура одного моля газу; а і b – поправки Ван-дер-Ваальса на внутрішній тиск і власний об’єм усіх молекул газу; R – універсальна газова стала.
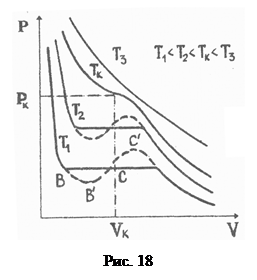
Для різних газів поправки а і b різні за значенням. На рис. 18 показані ізотерми реального газу для різних значень температур. Суцільні криві відповідають експериментальним, а криві з штрих-пунктирними ділянками ВВ 1 СС 1 – теоретичним ізотермам. З графіків видно, що з підвищенням температури горизонтальна ділянка ізотерми ВС, яка відповідає двофазовому стану речовини (рідина + насичена пара), зменшується, стягуючись за критичної температури ТK в точку, і дві фази речовини стають нерозрізнюваними. Цій точці відповідають параметри ТK, PK, VK, які визначають критичний стан речовини. Критичні параметри речовини ТK, PK, VK можна визначити, розв’язавши рівняння (1):
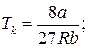
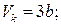
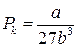 . (2)
. (2)
Критична температура – це температура, за якої зникає різниця між рідиною та її насиченою парою. При ТK питома теплота пароутворення і коефіцієнт поверхневого натягу рідини a дорівнюють нулю. При Т>ТK речовина може існувати лише в стані газу, який неможливо перевести в рідину шляхом ізотермічного стиску. При Т<ТK речовина може існувати у стані як рідини, так і насиченої пари.
 Критичний тиск – це максимально можливий тиск насиченої пари заданої речовини, а критичний об’єм – максимальне значення об’єму, який може займати речовина в рідкому стані.
Критичний тиск – це максимально можливий тиск насиченої пари заданої речовини, а критичний об’єм – максимальне значення об’єму, який може займати речовина в рідкому стані.
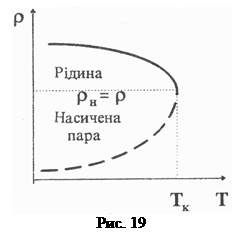
У нашому випадку досліджувана речовина перебуває в замкнутому об’ємі (ефір у запаяній скляній ампулі). Над поверхнею ефіру є насичена пара. З підвищенням температури інтенсивність випаровування ефіру збіль-шується, отже, густина пари r н також збільшується, а густина рідини r р – зменшується (рис. 19). Коли температура досягає критичної, то r н= r р. Поряд з цим, як зазначено вище, за такої температури a=0, тоді межа поділу між рідиною та її насиченою парою зникне.
Отже, експериментально ТK можна визначити шляхом візуального спостереження за зникненням (появою) меніска в запаяній скляній ампулі під час її нагрівання (охолодження). Цей метод, уперше запропонований київським фізиком М. Авенаріусом, застосований у нашій роботі.
Якщо в експерименті виміряти t 1°C (температуру, при якій зникає меніск в ампулі) і t 2°C– (температуру, за якої меніск з’являється, якщо ампулу охолоджувати), то ТK можна визначити так:
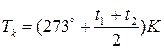 . (3)
. (3)
Вираз (3) є робочою формулою лабораторної роботи.
 2015-08-21
2015-08-21 807
807








