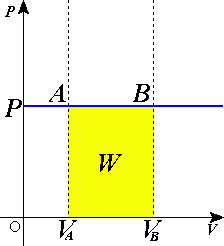
З визначення роботи слідує, що макроскопічна робота при нескінченно малій зміні об'єму на величину dV при ізобаричному процесі дорівнює:
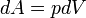
Повна робота процесу визначається інтегралом від даного виразу:
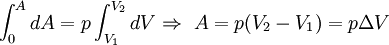 ,
,
де ΔV — зміна об'єму.
Розглядаючи графік ізобаричного процесу у координатах (p,V) отримати цей результат простіше. Графічно робота є площа фігури під кривою. У випадку ізобаричного процесу це площа прямокутника, яку знаходять за формулою, яку отримано в результаті інтегрування.
Якщо в останній формулі використати рівняння стану ідеального газу, то можна отримати такий результат:
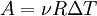
Де, ν — кількість речовини, R — універсальна газова стала, ΔT — зміна температури.
Зміна внутрішньої енергії ідеального газу може бути знайдена за формулою:
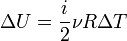 ,
,
де і — число ступенів вільності, яке залежить від кількості атомів у молекулі (3 для одноатомної (наприклад, водень), 5 для двоатомної (наприклад, кисень) і 6 для триатомної і більше (наприклад, молекула водяної пари)).
З визначення та формули теплоємності, формулу для внутрішньої енергії можна переписати у вигляді:
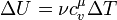 ,
,
де 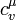 — молярна теплоємність при сталому об'ємі.
— молярна теплоємність при сталому об'ємі.
Застосувавши перше начало термодинаміки можна знайти кількість теплоти при ізобаричному процесі:
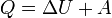
Тепер до цієї формули підставимо значення роботи та зміни внутрішньої енергії:
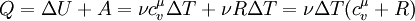
Застосувавши рівняння Роберта Майєра (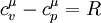 ) отримаємо:
) отримаємо:
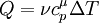 ,
,
де 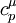 — молярна теплоємність при сталому тиску.
— молярна теплоємність при сталому тиску.
Теплоємність системи при ізобаричному процесі більша, ніж при ізохоричному, оскільки теплота потрібна не тільки для зміни внутрішньої енергії термодинамічної системи, а й для виконання цією системою роботи.
Всі формули, які подано вище виводилися з урахуванням незмінної маси речовини під час процесу, або відсутності параметра порядку при хімічній реакції.
 2015-09-06
2015-09-06 410
410







