Комментарии для работы с рабочими тетрадями.
| 1. F2 + CI2 →ОВР |
| 2. NaCI кр + H2SO4 конц → Обмен. Газообразный продукт удаляется из реакционной системы. |
| 3. PCI3 + H2O → гидролиз до фосфористой и соляной кислот. |
| 4. PbO2 + HCI →ОВР Свинец окислитель- до (+2), хлор восстановитель до молекулярного хлора. |
| 5. CIO2 + H2O → ОВР. Образующиеся хлорсодержащие кислоты содержат хлор в большей и меньшей степени окисления, чем в исходном оксиде. |
6. KCIO3  разложение без катализатора хлор диспропорционирует, с катализатором происходит внутримолекулярная ОВР между кислородом и хлором. разложение без катализатора хлор диспропорционирует, с катализатором происходит внутримолекулярная ОВР между кислородом и хлором.
|
| 7. FeSO4 + HCIO3 + H2SO4 → ОВР, железо восстановитель до (+3), хлор окислитель до …. |
| 8. Ca (CIO)2 + CO2 + H2O → Обмен осадок удаляется из реакционной системы. Образующаяся хлорноватистая кислота неустойчива и может легко разлагаться (ОВР). |
| 9. KBr + KBrO3 + H2SO4 → диспропорционирование до молекулярного брома. |
| 10. KJ + K3 [Fe(CN)6] → йод окисляется до (0) железо восстанавливается до +2. |
| 11. Fе + CI2 → с сильными окислителями железо до +3. |
12. NaCI + H2O 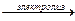 Обрзуется хлор и водород на катоде и аноде. Обрзуется хлор и водород на катоде и аноде.
|
| 13. CIО3 + NaOH → образуются соли сразу 2-х хлорсодержащих кислот с большей и меньшей степенью окисления хлора чем в исходном оксиде. |
| 14. НCIО4 + Р2О5 → дегидратация |
| 15. J2O7 + NaOH → солеобразование |
16. NaOH + CI2 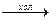 диспропорционирование хлора диспропорционирование хлора
|
| 17. КМnО4 + HCI → ОВР хлор восстановитель до свободного хлора, марганец окислитель до (+2). |
| 18. Br2 + J2 + Ва(ОН)2 → ОВР иод восстановитель до соли иодноватой кислоты, вром окислитель до (-1). |
| 19. NaCrO2 + Br2 + NaOH → ОВР хром восстановитель до соли дихромата, вром окислитель до (-1). |
| 20. KJ + HgJ2 →комплексообразование у ртути (+2) координационное число 4. |
| 21. S + F2 → ОВР |
| 22. BeF2 + SiF4→ комплексообразование у кремния координационное число 6. |
| 23. CI2 + H2O → диспропорционирование хлора |
| 24. NaCIO2 + H2O →гидролиз по аниону. |
25. KCIO4  ОВР. Хлор окислитель, кислород восстановитель. ОВР. Хлор окислитель, кислород восстановитель.
|
| 26. HCIO + NaOH → обмен, гипохлорит натрия не устойчив – сновное вещество содержащиеся в отбеливателе «белизна». |
27. NaOH + F2 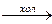 ОВР межмолекулярная фтор окислитель, кислород восстановитель. ОВР межмолекулярная фтор окислитель, кислород восстановитель.
|
| 28. CI2 + Br2 + NaOH → ОВР вром восстановитель до соли вромноватой кислоты, хлор окислитель до (-1). |
| 29. NaBr + AgNO3 →обмен |
| 30. Ca(CIO)2 + CO2 + H2O → угольная кислота более сильная, чем хлорноватистая, обмен, осадок. |
| 31. HF + SiO2 → обмен – плавиковая кислота по этой реакции разрушает стекло, поэтому её не хранят в стеклянной таре. |
| 32. K2Cr2O7 + HCI → ОВР хлор восстановитель до свободного хлора, хром окислитель до (+3). |
| 33. CIО3 + H2O → образуются сразу две хлорсодержащие кислоты с большей и меньшей степенью окисления хлора чем в исходном оксиде. |
34. KCIO  гипохлорит натрия и калия не устойчив – основное вещество содержащиеся в отбеливателе «белизна», отбеливающим эффектом обладает свободный кислород в момент прохождения данной реакции. гипохлорит натрия и калия не устойчив – основное вещество содержащиеся в отбеливателе «белизна», отбеливающим эффектом обладает свободный кислород в момент прохождения данной реакции.
|
35. Ca(OH)2 +CI2  ОВР образование «хлорки» (хлорной извести). ОВР образование «хлорки» (хлорной извести).
|
| 36. NaJ + CI2 → замещение – более сильный неметалл вытесняет более слабый из его соли. |
37. HCIO 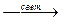 хлорноватистая кислота не устойчива, отбеливающим эффектом обладает свободный кислород в момент прохождения данной реакции. Дезинфицирующие действие хлорамина «А», «В» обусловлено выделением хлорноватистой кислоты при их гидролизе. хлорноватистая кислота не устойчива, отбеливающим эффектом обладает свободный кислород в момент прохождения данной реакции. Дезинфицирующие действие хлорамина «А», «В» обусловлено выделением хлорноватистой кислоты при их гидролизе.
|
| 38. CI2 + J2 +KOH → ОВР иод восстановитель до соли иодноватой кислоты, хлор окислитель до (-1). |
| 39. NaF + SiF4 → комплексообразование у кремния координационное число 6. |
| 40. NaCIO + KJ + H2SO4 → ОВР хлор восстановитель до соли хлорида, иод окислитель до (0). |
Индивидуальные задания:
|
|
|
|
|
|
1 вариант:
Как изменяются окислительные свойства галогенов при переходе от фтора к йоду и восстановительные свойства их электроотрицательных ионов? Почему? Составьте электронные и молекулярные уравнения реакций: а) Cl2 + I2 + H2O ® …; б) KI + Br2 ® … Укажите в них окислитель и восстановитель.
| Приведите сравнительную характеристику восстановительных и кислотных свойств галогеноводородов. Объясните наблюдаемые закономерности и подтвердите соответствующими уравнениями реакций. | Причину изменения указанных свойств в ряду галогеноводородов следует объяснять с точки зрения электронного строения галогенид – ионов. Восстановительные свойства галогенид – иона удобно объяснить на примере их взаимодействия сконцентрированной серной кислотой. Свойства галогеноводородов необходимо объяснять на основе строения галогенид – ионов в соответствии с их положением в периодической системе Д.И Менделеева. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
HCl ® Cl2 ® KClO3 ® KCl ® AgCl ® [Ag(NH3)2]Cl
2 вариант:
Что может свидетельствовать о том что в молекуле хлора тройная связь. Объясните возможность образования этой связи.
| Напишите уравнения реакций взаимодействия галогенов с водой и растворами щелочей (холодными и горячими). Определите коэффициенты электронно-ионным методом. Рассчитайте эквивалентные массы восстановителя в реакциях. | В водных растворах галогены диспропорционируют, при этом в холодных растворах образуются соединения со степенью окисления -1 и +1; в горячих -1 и +5. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
NаBr ® Br2 ®NаBrO3 ® Br2
3 вариант:
| Объясните изменение кислотно-основных свойств и окислительно-восстановительных свойств в ряду оксокислот: HCIO – HBrO – HIO. | Изменение указанных свойств необходимо объяснять с учетом строения атомов галогенов, положения их в периодической системе, сравнение величин их радиусов. |
| Напишите уравнения реакций получения хлорной извести. Объясните механизм антисептического действия хлорной извести. | Хлорная известь – это смешенная соль соляной и хлорноватистой кислот (хлорид – гипохлорит кальция). Антисептическое действие этой соли основано на сильных окислительных свойствах атомарного кислорода – продукта разложения хлорноватистой кислоты. |
F2 + CI2 →ОВР
CIO2 + H2O →
KCIO3  разложение
разложение
FeSO4 + HCIO3 + H2SO4 →
4 вариант:
Закончите уравнения реакций:
NaCrO2+Br2+NaOH  NaCrO4+...,
I2 + CI2 + H2O NaCrO4+...,
I2 + CI2 + H2O  .
Определите коэффициенты электронно-ионным методом. Сравните окислительные свойства галогенов. .
Определите коэффициенты электронно-ионным методом. Сравните окислительные свойства галогенов.
| Галогены – сильные окислители. Бром окисляет хром (III) в хром (VI). С увеличением порядкового номера окислительные свойства галогенов ослабевают. хлор – более сильный окислитель по сравнению с йодом. |
Закончите уравнения реакций и подберите коэффициенты электронно-ионным методом:
I2 + HNO3(конц)  ,
I2 + CI2 + H2O ,
I2 + CI2 + H2O  ,
KJ + H2O2 + H2O ,
KJ + H2O2 + H2O  Рассчитайте эквивалентные массы восстановителя в каждой реакции.
Рассчитайте эквивалентные массы восстановителя в каждой реакции.
| С возрастанием порядкового номера окислительные свойства галогенов ослабевают, восстановительные свойства галогенид – ионов усиливаются. I2 и Br2 под действием сильных окислителей окисляются до соответствующих кислородсодержащих кислот со степенью окисления галогенов +5. Иодид – ион окисляется до ближайшей степени окисления. |
KBr + KBrO3 + H2SO4 → диспропорционирование до молекулярного брома.
|
|
|
KJ + K3 [Fe(CN)6] → йод окисляется до (0) железо восстанавливается до +2.
Fе + CI2 → сильными окислителями железоокисляется до с.о. +3.
NaCI + H2O 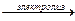 Обрзуются хлор и водород
Обрзуются хлор и водород
CIО3 + NaOH → образуются соли сразу 2-х хлорсодержащих кислот с большей и меньшей с.о., хлора
5 вариант:
Закончите уравнения реакций:
KBr + MnO2 + H2SO4  ,
KBr + KBrO3 + H2SO4 ,
KBr + KBrO3 + H2SO4  ,
KBr + KMnO4 + H2SO4 ,
KBr + KMnO4 + H2SO4  .
Определите коэффициенты электронно-ионным методом. .
Определите коэффициенты электронно-ионным методом.
| Бромид – ион окисляется с помощью диоксида марганца, бромата калия и перманганата калия до свободного хрома. |
| Напишите уравнения реакций взаимодействия галогенов с водой и растворами щелочей (холодными и горячими). Определите коэффициенты электронно-ионным методом. Рассчитайте эквивалентные массы восстановителя в реакциях. | В водных растворах галогены диспропорционируют, при этом в холодных растворах образуются соединения со степенью окисления -1 и +1; в горячих -1 и +5. |
NaOH + CI2 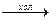 диспропорционирование хлора на ближайшую положительную и ближайшую отрицательную с.о.
диспропорционирование хлора на ближайшую положительную и ближайшую отрицательную с.о.
КМnО4 + HCI → ОВР хлор восстановитель до свободного хлора, марганец окислитель до (+2).
Br2 + J2 + Ва(ОН)2 → ОВР иод восстановитель до соли иодноватой кислоты, вром окислитель до (-1).
NaCrO2 + Br2 + NaOH → ОВР хром восстановитель до соли дихромата, вром окислитель до (-1).
S + F2 → ОВР
CI2 + H2O → диспропорционирование хлора на ближайшую положительную и ближайшую отрицательную степень окисления.
KCIO4 
6 вариант:
Закончите уравнения реакций:
KI + KIO3 + H2SO4  ,
KI + K2Cr2O7 + H2SO4 ,
KI + K2Cr2O7 + H2SO4  ,
KI + Br2 ,
KI + Br2  Определите коэффициенты электронно-ионным методом. Рассчитайте эквивалентные массы восстановителя в реакциях.
Определите коэффициенты электронно-ионным методом. Рассчитайте эквивалентные массы восстановителя в реакциях.
| Во всех случаях йодид – ион окисляется до свободного йода. |
KCIO  гипохлорит натрия и калия не устойчив – основное вещество содержащиеся в отбеливателе «белизна», отбеливающим эффектом обладает свободный кислород в момент прохождения данной реакции.
гипохлорит натрия и калия не устойчив – основное вещество содержащиеся в отбеливателе «белизна», отбеливающим эффектом обладает свободный кислород в момент прохождения данной реакции.
|
|
|
Ca(OH)2 +CI2  ОВР образование «хлорки» (хлорной извести).
ОВР образование «хлорки» (хлорной извести).
NaJ + CI2 → – более сильный окислитель вытесняет более слабый из его соли.
HCIO 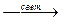 хлорноватистая кислота не устойчива.
хлорноватистая кислота не устойчива.
CI2 + J2 +KOH → ОВР иод восстановитель до соли иодноватой кислоты, хлор окислитель до (-1).
NaCIO + KJ + H2SO4 → ОВР хлор восстановитель до соли хлорида, иод окислитель до (0).
7 вариант:
Закончите уравнения реакций:
HCI + CaOCI2  , (один из лабораторных способов получения хлора).
H2S + K2Cr2O7 + H2SO4 , (один из лабораторных способов получения хлора).
H2S + K2Cr2O7 + H2SO4  , HCI + PbO2 , HCI + PbO2  .
Определите коэффициенты электронно-ионным методом. .
Определите коэффициенты электронно-ионным методом.
| Хлорид – ионы окисляются сильными окислителями (хлорная известь, диоксид свинца) до свободного хлора. Сероводорода, пропущенный через подкисленный раствор дихромата калия, окисляется до элементарной серы. |
NaOH + F2 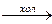 ОВР межмолекулярная ОВР, фтор окислитель, кислород восстановитель.
ОВР межмолекулярная ОВР, фтор окислитель, кислород восстановитель.
CI2 + Br2 + NaOH → ОВР вром восстановитель до соли вромноватой кислоты, хлор окислитель до (-1).
K2Cr2O7 + HCI → ОВР хлор восстановитель до свободного хлора, хром окислитель до (+3).
HCIO 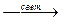 хлорноватистая кислота не устойчива – основное вещество содержащиеся в отбеливателе «белизна», отбеливающим эффектом обладает свободный кислород в момент прохождения данной реакции.
хлорноватистая кислота не устойчива – основное вещество содержащиеся в отбеливателе «белизна», отбеливающим эффектом обладает свободный кислород в момент прохождения данной реакции.
KCIO  гипохлорит натрия и калия не устойчив – основное вещество содержащиеся в отбеливателе «белизна», отбеливающим эффектом обладает свободный кислород в момент прохождения данной реакции.
гипохлорит натрия и калия не устойчив – основное вещество содержащиеся в отбеливателе «белизна», отбеливающим эффектом обладает свободный кислород в момент прохождения данной реакции.
Ca(OH)2 +CI2  ОВР образование «хлорки» (хлорной извести).
ОВР образование «хлорки» (хлорной извести).
NaJ + CI2 → замещение – более сильный неметалл вытесняет более слабый из его соли.
CIО3 + H2O → образуются хлорсодержащие кислоты с большей и меньшей степенью окисления хлора, чем в исходном оксиде.
 2015-10-16
2015-10-16 1341
1341








