1. Составьте полные уравнения ядерных превращений:
· 59Co (n, α) ® …
· 253Es (α, n) ® …
· 242Сm (α, 2n) ® …
2. Определите природу частиц, образующихся в результате ядерных превращений. Установите массовое число и порядковый номер образующихся атомов.
a. b- a b+
3. 82212Pb ¾¾® X ¾¾® Y ¾¾® Z
4. Образец чистого углерода массой 0,25 г содержит 15% радиоактивного изотопа 14С, период полураспада которого равен 5470 лет. Какова масса образца через 100 лет? Какова будет массовая доля изотопа 14С в образце?
5. Рассчитайте длину волны де Бройля, которая соответствует α-частице с массой 6,6.10-27 кг, движущейся со скоростью 70 м/с.
6. Рассчитайте энергию, поглощаемую атомом водорода при переходе электрона из состояния n=1 в состояние n=2. Оцените радиусы первой и второй боровских орбит и рассчитайте скорости электрона на этих орбитах, используя постулаты теории Бора.
7. Составьте электронные конфигурации для атомов бериллия и бора в основном и первом возбужденном состоянии.
8. Составьте электронные конфигурации для атомов хрома, иттрия, гафния, актиния, резерфордия.
|
|
|
9. Запишите электронные конфигурации для нейтрального атома брома в основном и первом возбужденном состоянии, а также в степенях окисления -1, +1, +3, +5, +7. Для каждого внешнего электрона нейтрального атома брома в основном состоянии запишите наборы значений четырех квантовых чисел.
10. Принцип изоэлектронности. Составьте изоэлектронный ряд ксенона.
11. Какова максимальная валентность атомов элементов второго периода? Третьего периода? d- и f-элементов? Обсудите возможность существования молекул NF3, NF5, PF3, PF5.
12. Энергия диссоциации молекулы иодоводорода равна 298,4 кДж/моль. Можно ли разложить молекулу иодоводорода на атомы при облучении ультрафиолетовым светом с l=2×10-7 м? Какую энергию надо затратить, чтобы разложить 0,05 г HI?
13. Длина связи С-С составляет 1,54×10-10 м, а межъядерное расстояние в молекуле водорода равно 0,74×10-10 м. Рассчитайте длину химической связи в молекуле метана.
14. Рассчитайте энергию химической связи в молекуле фторида ксенона(IV), если при образовании XeF4 из простых веществ выделяется 230 кДж/моль теплоты, а энергия связи в молекуле фтора составляет 159 кДж/моль.
15. Какие из d-АО центрального атома участвуют в образовании s-связей в плоских квадратных молекулах? В молекулах, построенных в виде тригональной бипирамиды? В октаэдрических молекулах?
16. Молекула SiF4 может присоединять фторид ионы с образованием SiF62--иона. В полученном ионе все шесть связей одинаковы. Укажите тип гибридизации внешних АО атома кремния в этом ионе. Какие из d-АО участвуют в образовании σ-связей в этом ионе? Представьте пространственные диаграммы этих АО и расставьте знаки ψ-функции.
|
|
|
17. Объясните природу связи в соединении NH3.BF3.
18. Какова гибридизация внешних атомных орбиталей центрального атома в молекулах аммиака и фторида бора, если известно, что валентные углы в этих молекулах равны 107° и 120° соответственно?
19. Валентный угол между связями в молекулах газообразных гидридов элементов шестой группы равны: в H2O - 104,5°; в H2S - 92°; в H2Se - 91°; в H2Te - 89,5°. Объясните причину изменения валентных углов в указанных соединениях при переходе вниз по подгруппе (O-S-Se-Te).
20. Согласно результатам экспериментальных измерений валентный угол в молекуле NH3 равен 107°. Рентгеноструктурные исследования молекулы воды показали, что валентный угол в этой молекуле равен 104,5°. Чем объяснить тот факт, что несмотря на большее число связей в молекуле аммиака, чем в молекуле воды, валентный угол HNH больше валентного угла HOH?
21. Почему соединение SF6 существует, а соединения SH6 нет; соединение TiCl4 - существует, а TiH4 - нет?
22. Объясните, почему молекула СО2 неполярна, хотя каждая связь <С-О> характеризуется высоким моментом электрического диполя (3,7.10-29 Кл.м).
23. Почему молекула метана СН4 неполярна, а молекула воды Н2О имеет постоянный дипольный момент 1,8 D? Поясните.
24. Используя метод ВС, определите геометрию следующих частиц и тип гибридизации внешних атомных орбиталей центрального атома: AlBr3, BeF2, CF4, SbCl5, PbCl62-, CO2. Каков тип гибридизации атомных орбиталей центральных атомов в этих молекулах. Какие из АО участвует в образовании σ-связей в этих молекулах? Представьте пространственную диаграмму этих АО и расставьте знаки ψ-функции.
25. Используя метод ВС представьте канонические и резонансные ВС для молекул азотной кислоты, оксида азота(IV) и озона.
26. Используя теорию Гиллеспи, покажите, какие среди молекул NH3, H2O, CO2, H2S, AlCl3 являются неполярными.
27. Двухатомные молекулы и молекулярные ионы элементов I периода в методе МО.
28. Двухатомные молекулы элементов II периода в методе МО. Гомо- и гетероатомные молекулы. s- и p-МО базиса sp.
29. Что прочнее: молекула N2 или молекула СО? Молекулярный ион водорода Н+2 или молекула Н2? Почему?
30. Используя метод МО, постройте энергетические диаграммы O2, O2+ и O2-. Запишите электронные конфигурации нейтральной молекулы и молекулярных ионов. Укажите диа- и парамагнитные частицы. Рассчитайте порядок связи в нейтральной молекуле и молекулярных ионах. В какой из этих частиц химическая связь наиболее прочная?
31. Зависимость температуры кипения жидких водородных соединений шестой группы от порядкового номера не является монотонной: H2O (100 °С), H2S (-60 °С), H2S (-41 °С), H2Te (-2 °С). Чем объясняется аномально высокое значение температуры кипения воды?
32. Вода при обычных условиях – жидкость, а сероводород - газ. Почему? Рассмотрите механизм образования водородных связей между молекулами воды в жидкой воде. Как меняется структура воды при переходе в твердое агрегатное состояние? Почему лед легче жидкой воды?
33.  Какие виды межмолекулярных взаимодействий, обеспечивают жидкое агрегатное состояние CO2, Cl2, H2S, NH3?
Какие виды межмолекулярных взаимодействий, обеспечивают жидкое агрегатное состояние CO2, Cl2, H2S, NH3?
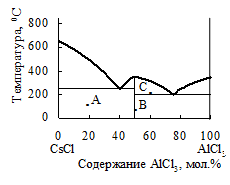
34. На основе фазовой диаграммы системы CsCl – AlCl3 установите состав образующегося в системе химического соединения и охарактеризуйте его устойчивость. Определите число и состав фаз, а также число степеней свободы в точках А, В и С фазовой диаграммы этой системы. Укажите на диаграмме точки, в которых реализуются нонвариантные равновесия. Нарисуйте кривую охлаждения для расплава, содержащего 10% AlCl3.
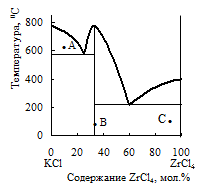
35. На основе фазовой диаграммы системы KCl – ZrCl4 установите состав образующегося в системе химического соединения и охарактеризуйте его устойчивость. Определите число и состав фаз, а также число степеней свободы в точках А, В и С фазовой диаграммы этой системы. Укажите на диаграмме точки, в которых реализуются нонвариантные равновесия. Нарисуйте кривую охлаждения для расплава, содержащего 80% ZrCl4.
|
|
|
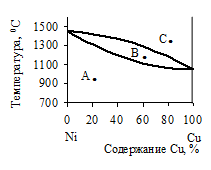
36. На основе фазовой диаграммы системы Ni – Cu укажите температуры начала и завершения процесса кристаллизации смеси, содержащей 60% Сu. Определите число и состав фаз, а также число степеней свободы в точках А, В и С фазовой диаграммы этой системы. Нарисуйте кривую охлаждения для расплава, содержащего 40% Cu.
 2015-10-16
2015-10-16 1858
1858






