Белки (протеины) – высокомолекулярные азотсодержащие биополимеры, структурными единицами которых являются аминокислоты, соединенные между собой пептидными связями. В настоящее время известно около 1010–1012 различных белков, обеспечивающих существование около 106 видов живых организмов разной сложности организации (от вирусов до человека). Такое многообразие белков обеспечивается разным количественным соотношением и порядком расположения в них остатков аминокислот.
Аминокислоты, из которых построены молекулы всех белков живой природы, являются α-аминокислотами, т.е. карбоновыми кислотами, содержащими аминную и карбоксильную группы, находящиеся у одного и того же атома углерода. Число существующих в природе аминокислот очень велико, однако далеко не все они входят в состав организма человека. В организме встречается до 70 аминокислот, но только 20 из них являются протеиногенными. Протеиногенными называют аминокислоты, входящие в состав нативных (природных) белков. Общую формулу α-аминокислот можно представить следующим образом:
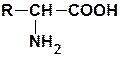
R – радикал аминокислоты – в простейшем случае представлен атомом водорода (глицин), но может иметь и довольно сложное строение. Кроме наиболее часто встречающихся, имеется ряд минорных аминокислот, являющихся компонентами только некоторых белков. Каждая из этих минорных аминокислот представляет собой химическую модификацию основных протеиногенных аминокислот, например гидроксипролин или гидроксилизин.
Для человека десять из двадцати протеиногенных аминокислот являются незаменимыми, т.е. в организме не синтезируются и обязательно должны поступать в организм в составе пищи.
Таблица 1. Аминокислоты, входящие в состав белков
| Заменимые | Незаменимые | Заменимые | Незаменимые |
| Аланин Аспарагиновая кислота Аспарагин Глицин Глутамин | Аргинин* Валин Гистидин* Изолейцин Лейцин | Глутаминовая кислота Пролин Серин Тирозин Цистеин (цистин) | Лизин Метионин Треонин Триптофан Фенилаланин |
* – частично заменимые аминокислоты
Белки содержат от нескольких десятков до тысяч аминокислотных остатков, и молекулярная масса их колеблется в пределах от 10000 до нескольких миллионов дальтон (Да). Содержание белков в тканях человеческого организма (от массы сухой ткани) колеблется от 14% в жировой ткани до 80-85% в поперечнополосатых мышцах, легких и селезенке.
Химический состав всех белков близок, они содержат примерно по:
– 50-54% углерода;
– 21-23% кислорода;
– 6,5-7,3% водорода;
– 15-17% азота;
– до 0,5% серы.
Многие белки в своем составе содержат также фосфор, а в состав некоторых могут входить также металлы (железо, цинк, медь, магний и др.) и неметаллы (например, йод).
С белками связаны все наиболее важные функции живых организмов:
Структурная функция. Белки, выполняющие структурную (опорную) функцию, занимают по количеству первое место среди других белков тела человека. Среди них важнейшую роль играют фибриллярные белки, в частности коллаген в соединительной ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке и др. В комплексе с липидами (в частности, с фосфолипидами) белки участвуют в образовании биомембран клеток.
Каталитическая. Белки участвуют в ускорении химических реакций в организме. Большинство известных в настоящее время ферментов, называемых биологическими катализаторами, является белками.
Транспортная функция. Дыхательная функция крови, в частности перенос кислорода, осуществляется молекулами гемоглобина – белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки крови. Ряд других сывороточных белков образует комплексы с жирами, медью, железом, тироксином, витамином А и другими соединениями, обеспечивая их доставку в соответствующие органы-мишени.
Защитная функция. Основную функцию защиты в организме выполняет иммунная система, которая обеспечивает синтез специфических защитных белков-антител в ответ на поступление в организм бактерий, токсинов, вирусов или чужеродных белков. Защитная функция белков проявляется и в способности ряда белков плазмы крови, в частности фибриногена, к свертыванию. В результате свертывания фибриногена образуется сгусток крови, предохраняющий от потери крови при ранениях.
Сократительная функция. В акте мышечного сокращения и расслабления участвует множество белковых веществ. Однако главную роль в этих жизненно важных процессах играют актин и миозин – специфические белки мышечной ткани. Сократительная функция присуща не только мышечным белкам, но и белкам цитоскелета, что обеспечивает тончайшие процессы жизнедеятельности клеток (расхождение хромосом в процессе митоза).
Регуляторная функция. Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляции важное место занимают гормоны, синтезируемые не только в железах внутренней секреции, но и во многих других клетках организма. Ряд гормонов представлен белками или полипептидами, например гормоны гипофиза, поджелудочной железы и др. Некоторые гормоны являются производными аминокислот.
Питательная (резервная) функция. Эту функцию выполняют так называемые резервные белки, являющиеся источниками питания для плода, например белки яйца (овальбумины). Основной белок молока (казеин) также выполняет главным образом питательную функцию.
Наиболее характерными физико-химическими свойствами белков являются: высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, способность к ионизации и подвижность в электрическим поле, низкое осмотическое и высокое онкотическое давление, способность поглощать УФ-лучи за счет наличия в белках ароматических аминокислот, ионизация и гидратация.
Белки амфотерны благодаря наличию свободных NH2-групп и СООН-групп (как концевых, вносящих незначительный вклад в кислотно-основные свойства белка, так и дополнительных амино- и карбоксильных групп боковых радикалов остатков аминокислот). В нейтральной среде эти группы ионизируют, вследствие чего аминогруппа имеет положительный, а карбоксильная – отрицательный заряд:
–NH2 + H+ → –NH3+
–COOH → – COO– + H+
В зависимости от соотношения кислых и основных аминокислот и реакции среды белки в растворе могут нести или отрицательный, или положительный заряд, и перемещаться в постоянном электрическом поле к аноду или к катоду. Это свойство используется при очистке белка методом электрофореза.
Если суммарный заряд белковой молекулы равен нулю, то говорят об изоэлектрическом состоянии. Значение рН среды, при котором белок находится в изоэлектрическом состоянии, т.е. его заряд равен нулю, называется изоэлектрической точкой – pI. В этой точке белок наименее устойчив в растворе и легко выпадает в осадок. Для большинства белков животных тканей изоэлектрическая точка лежит в пределах 5,5–7,0 (однако встречаются и исключения: величина pI пепсина равна 1,5, а pI сальмина – 12).
Молекула белка дифильна, в ней имеются гидрофильные (полярные) и гидрофобные (неполярные) группы, причем гидрофильные в большинстве нативных белков находятся на поверхности, а гидрофобные – внутри белковой молекулы. Взаимодействие полярных групп с молекулами воды приводит к образованию вокруг белковой молекулы гидратной оболочки. Это явление носит название «гидратация». Большинство белков обладает ярко выраженными гидрофильными свойствами, причем степень их гидрофильности, а значит и растворимость, выражена тем сильнее, чем больше гидрофильных аминокислот входит в их состав. Белки образуют коллоидные растворы, обладающие всеми свойствами коллоидов – высокой вязкостью, неспособностью к прохождению через полупроницаемые мембраны, медленной диффузией, способностью к седиментации, оптическими свойствами (опалесценцией, светорассеиванием, светопреломлением и т.д.).
 2015-10-16
2015-10-16 963
963







