Процесс самопроизвольного выравнивания концентраций веществ в термодинамической системе называют диффузией.
Диффузия является двусторонним процессом. Так, в растворах в процессе диффузии участвуют как молекулы растворителя, так и молекулы (ионы) растворенных веществ.
Процесс преимущественно одностороннего проникновения молекул растворителя через полупроницаемую мембрану называют осмосом.
В процессе осмоса, молекулы растворителя проникают через полупроницаемую мембрану либо из растворителя в раствор, либо из разбавленного раствора в более концентрированный.
Явление осмоса схематично представлено на рис. 2, из которого видно, что в процессе осмоса уровень жидкости в объеме с раствором глюкозы повышается. При этом создается дополнительное гидро-статическое давление, препятствующее дальнейшему проникновению растворителя через мембрану.
Дополнительное гидростатическое давление, при котором осмос прекращается, называют осмотическим давлением.
Осмотическое давление обозначают буквой p и выражают в кПа или в атм.
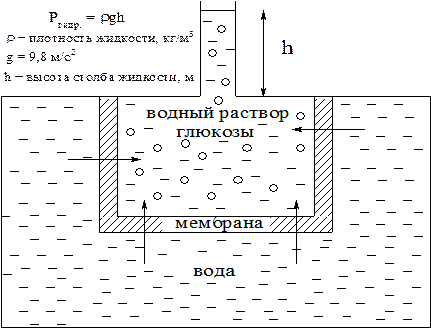
Рис. 2. Явление осмоса.
Изучая осмотические явления, Вант-Гофф установил их полную аналогию с законами поведения идеальных газов.
Закон Вант-Гоффа:
Осмотическое давление разбавленных растворов неэлектро-литов прямо пропорционально молярной концентрации раствора и абсолютной температуре:
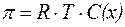 | (6) |
где С(х) - молярная концентрация раствора, моль/л;
R - газовая постоянная (8,31 Дж/(моль×К); 0,082 л×атм/(моль×K));
Т - абсолютная температура (К).
Интересно отметить, что даже при сравнительно небольших кон-центрациях, растворы могут обладать значительным осмотическим давлением. Так, осмотическое давление одномолярного раствора глюкозы при 00С составляет 22,4 атм.
 2015-10-16
2015-10-16 4340
4340
