Из рис. 1 видно, что при равных концентрациях растворов дав-ление насыщенного пара растворителя над раствором электролита (кривая 3) ниже, чем над раствором неэлектролита той же концентра-ции (кривая 2). Это объясняется тем, что диссоциацияэлектролита приводит к увеличению общего числа частиц растворенного вещества. Вследствие сольватации образовавшихся ионов умень-шается количество свободных молекул растворителя на поверхности раздела жидкость-пар. Таким образом, свойства, зависящие от общего числа находящихся в растворе частиц растворенного вещества (коллигативные свойства), проявляются в растворах электролитов в большей степени, чем в равных им по концентрации растворах неэлектролитов.
Если в результате диссоциации общее число частиц в растворе электролита возросло в i раз по сравнению с числом его молекул, то это должно быть учтено при расчете коллигативных свойств:
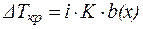 , , | (7) |
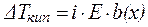 | (8) |
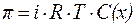 | (9) |
где i – изотонический коэффициент (коэффициентВант-Гоффа).
Изотонический коэффициент i связан со степенью диссоциации электролита a следующим соотношением:
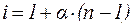 , , | (10) |
где n – число ионов, на которые при диссоциации распадается электролит.
Пример 1. Рассчитать изотонический коэффициент Вант-Гоффа для АlСl3, если «кажущаяся» степень диссоциации 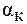 = 80%.
= 80%.
Решение.
В растворе сильного электролита изотонический коэффициент рассчитывается по формуле:
i = 1 + 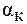 ∙(n – 1).
∙(n – 1).
Степень диссоциации 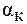 выражается в долях единицы и равна 0,8. Для расчета n, т.е. числа ионов, на которые диссоциирует электролит, необходимо написать уравнение диссоциации:
выражается в долях единицы и равна 0,8. Для расчета n, т.е. числа ионов, на которые диссоциирует электролит, необходимо написать уравнение диссоциации:
AlCl3 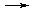 Al3+ + 3Cl-
Al3+ + 3Cl-
Таким образом:
n = 4,
i = 1 + 0,8×(4 – 1) = 3,4.
По опытным величинам p, DTкип. и DTкр. можно определить значение i, что, в свою очередь, позволяет вычислить степень диссоциации электролита в растворе. При этом следует иметь в виду, что в случае сильных электролитов найденное таким образом значение 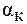 выражает лишь «кажущуюся» степень диссоциации, поскольку в растворах сильные электролиты диссоциированы полностью. Наблюдаемое отличие «кажущейся» степени диссоци-ации от единицы связано с межионным взаимодействием в растворе.
выражает лишь «кажущуюся» степень диссоциации, поскольку в растворах сильные электролиты диссоциированы полностью. Наблюдаемое отличие «кажущейся» степени диссоци-ации от единицы связано с межионным взаимодействием в растворе.
 2015-10-16
2015-10-16 3246
3246








