Процессы фазового перехода сопровождаются выделением или поглощением теплоты. Зависимость между теплотой фазового перехода и внешними условиями выражается уравнением Клапейрона – Клаузиуса:
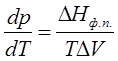 или
или 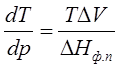 , (3.5)
, (3.5)
где ΔНф.п. – теплота фазового перехода; ΔV – изменение молярного объема при переходе из одной фазы в другую, 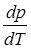 – температурный коэффициент давления (величина, показывающая, как изменится давление при изменении температуры).
– температурный коэффициент давления (величина, показывающая, как изменится давление при изменении температуры).
В процессе плавления (кривая ОВ, рис.3.1), объем образующейся жидкой фазы больше объема твердой фазы (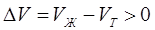 ) и производная
) и производная 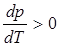 , поэтому с увеличением давления температура плавления увеличивается. На рис.3.2 показан процесс плавления, в котором объем твердой фазы больше объема жидкой фазы (
, поэтому с увеличением давления температура плавления увеличивается. На рис.3.2 показан процесс плавления, в котором объем твердой фазы больше объема жидкой фазы (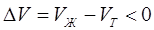 ) и производная
) и производная 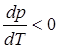 , это означает, что с ростом давления температура плавления вещества уменьшается (кривая ОВ, рис.3.2). Таким свойством обладает только небольшое число веществ, например, вода, висмут, сурьма, чугун.
, это означает, что с ростом давления температура плавления вещества уменьшается (кривая ОВ, рис.3.2). Таким свойством обладает только небольшое число веществ, например, вода, висмут, сурьма, чугун.
В процессе испарения и возгонки (кривые ОС и ОА на рис. 3.1 и рис. 3.2) производная 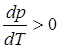 , поэтому при повышении давления температуры кипения и возгонки всегда увеличиваются.
, поэтому при повышении давления температуры кипения и возгонки всегда увеличиваются.
|
|
|
Точка О называется тройной точкой, так как в ней могут находиться в равновесии одновременно три фазы: твердая, жидкая и газообразная. Число степеней свободы в тройной точке равно: С = 3 ─ Ф = 3 ─ 3= 0. Это значит, что произвольно нельзя изменять ни один из параметров, иначе состояние равновесия в системе изменится.
Давление, которое молекулы пара, находящегося в равновесии с жидкой фазой, оказывают на стенки сосуда и на поверхность жидкости, называется давлением насыщенного пара (для краткости давление пара жидкости).
Согласно правилу фаз система с одним компонентом и двумя сосуществующими фазами имеет только одну степень свободы С = 3 ─ Ф = 3 ─ 2 = 1. Следовательно, в процессе испарения можно произвольно изменять один из параметров (либо температуру, либо давление), и при этом не изменится число и природа фаз.
Давление пара над поверхностью стабильного химического вещества (жидкости или твердого тела) определяется только температурой и не зависит от количества взятого вещества, от количества пара и от наличия и концентрации воздуха или другого газа, инертного по отношению к другому пару.
Пример 3.1. Как изменится температура плавления льда при повышении давления на 1 атм, если известно, что при 0°С теплота плавления льда равна 333,5 Дж/г, а удельные объемы воды и льда соответственно равны 1,0001·10-6 м3/г и 1,0908·10-6 м3/г?
Решение:
Плавление льда представляет собой фазовый переход:
твердое вещество →жидкость.
Запишем уравнение Клапейрона – Клаузиуса для процесса плавления в следующем виде:
|
|
|
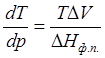
Т=273К, ΔV=Vж – Vтв = 1,0001·10-6 – 1,0908·10-6 = –9,07·10-8 м3/г;
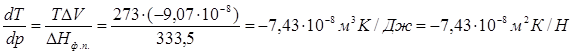
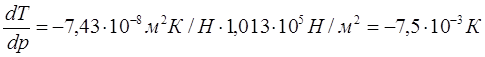
При повышении давления на 1 атм температура плавления льда снизится на 0,0075 градуса.
 2015-10-13
2015-10-13 4096
4096








