Пример 1. Воздух, всасываемый в компрессор при давлении p1=0,1 МПа и температуре t1= 20°С, сжимается до давления 0,5 МПа. Определить теоретическую работу сжатия и внутренний относительный КПД, если температура воздуха в конце сжатия равна t2 = 220 °С.
Решение. Ход расчета показан на рис. 3.
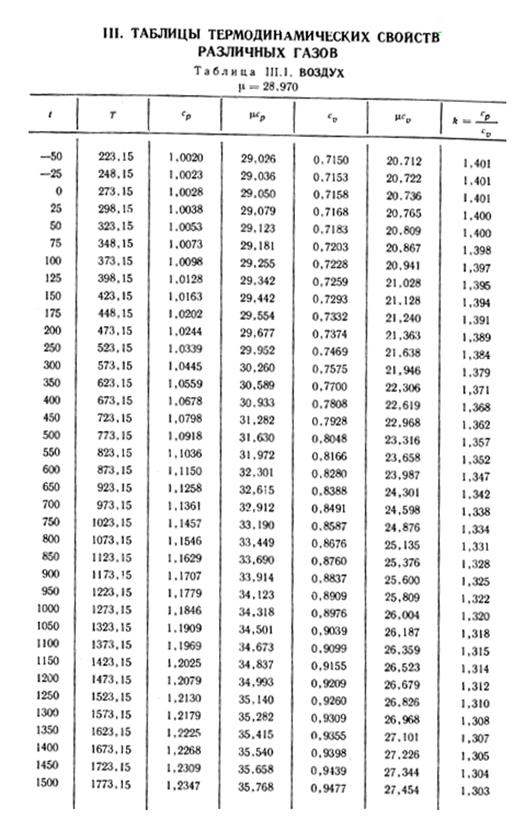
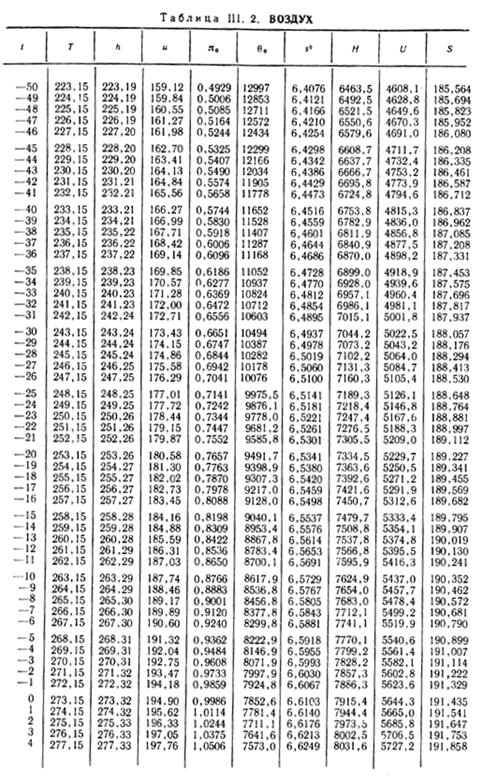
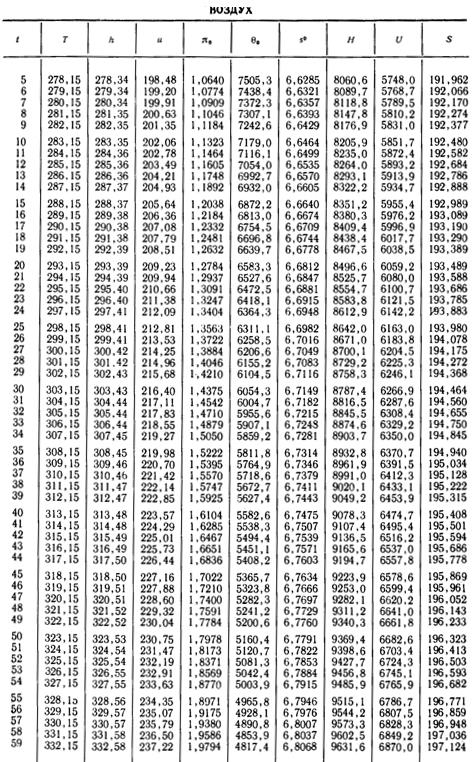
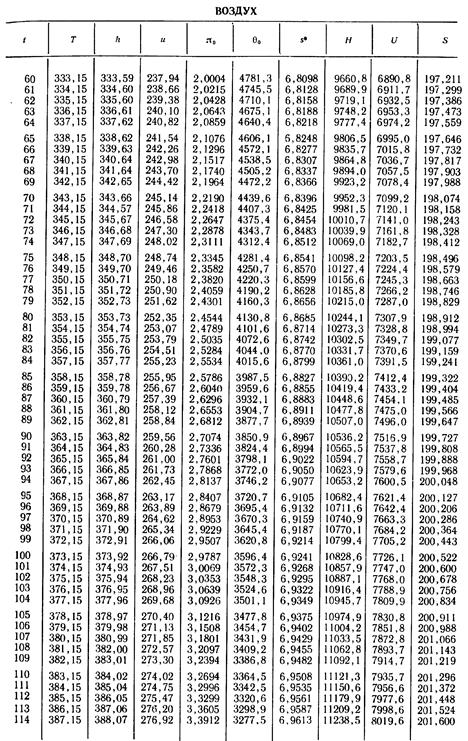
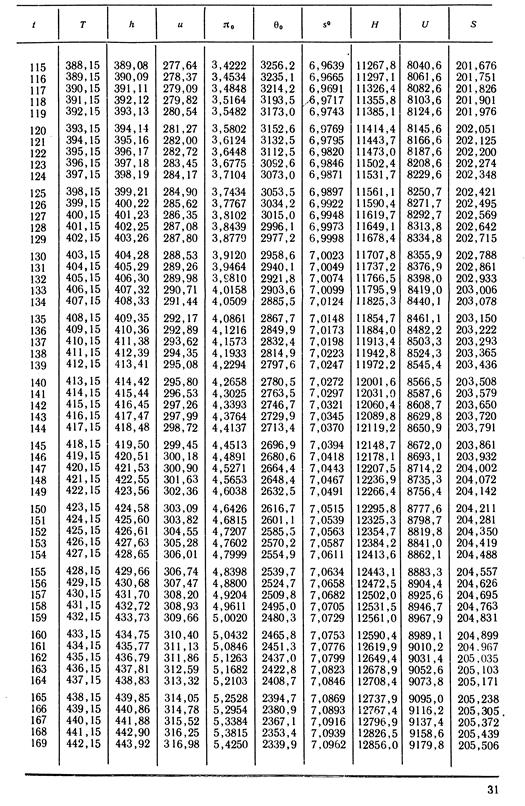
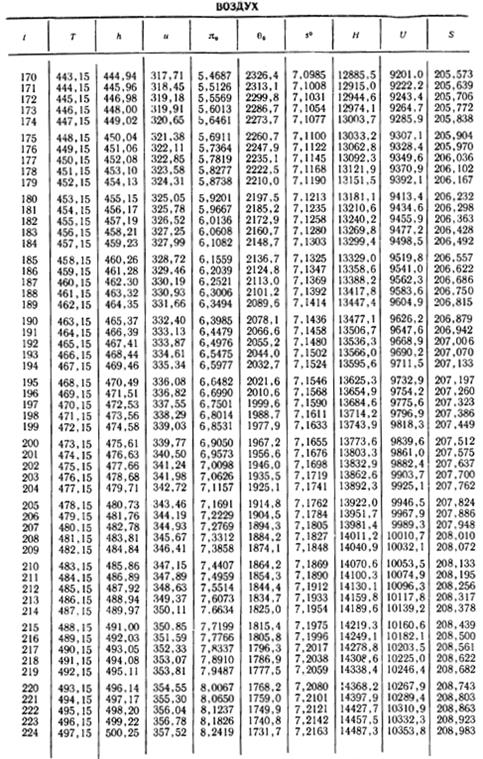
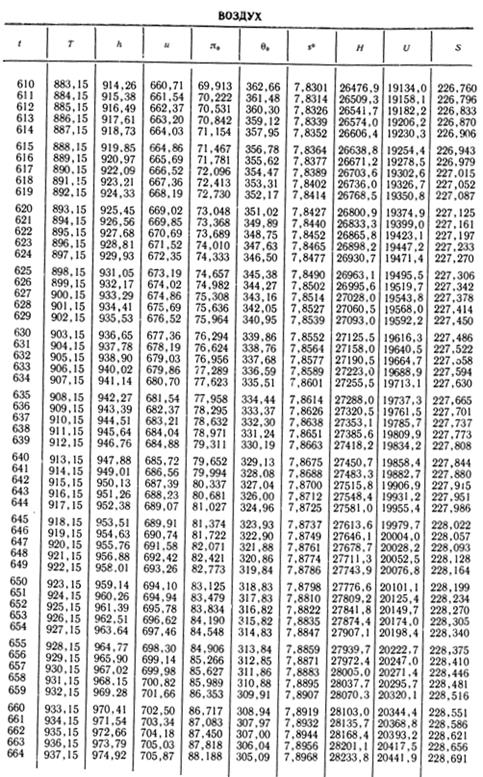
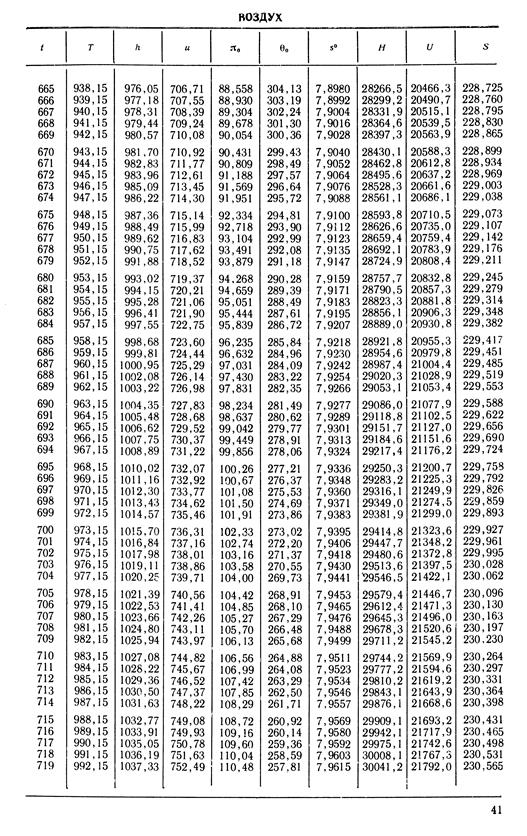
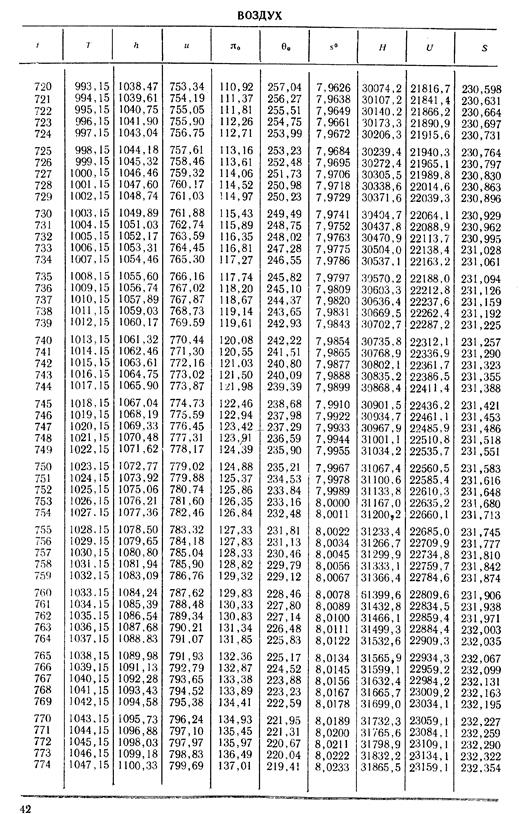
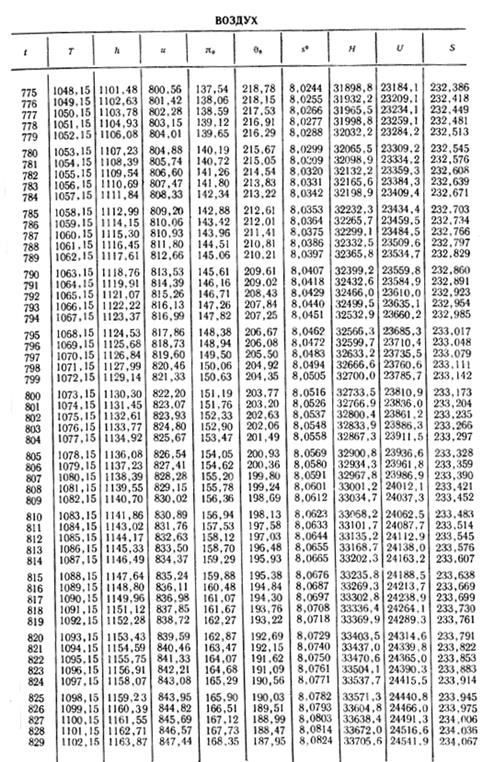
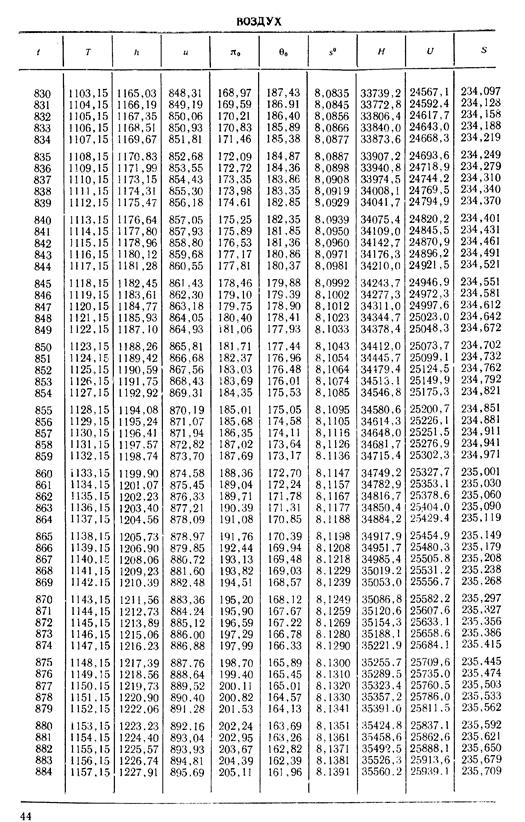
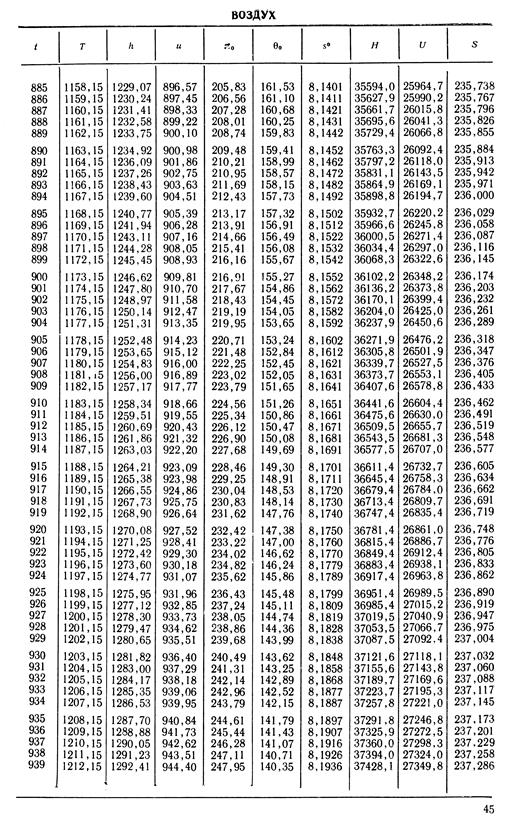
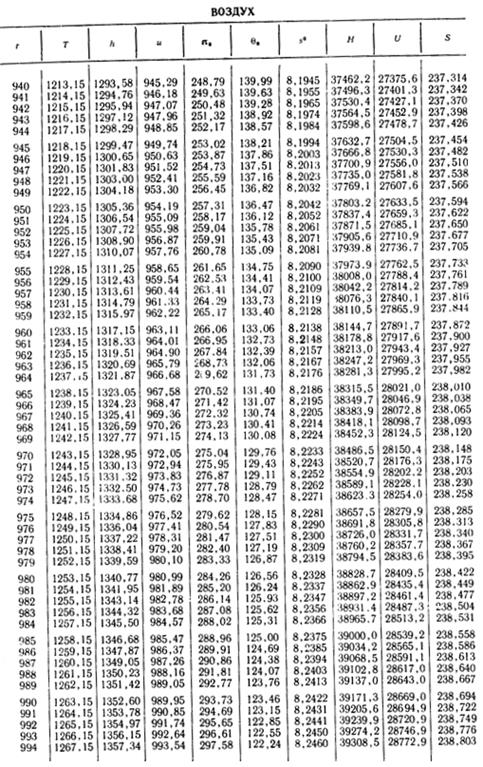
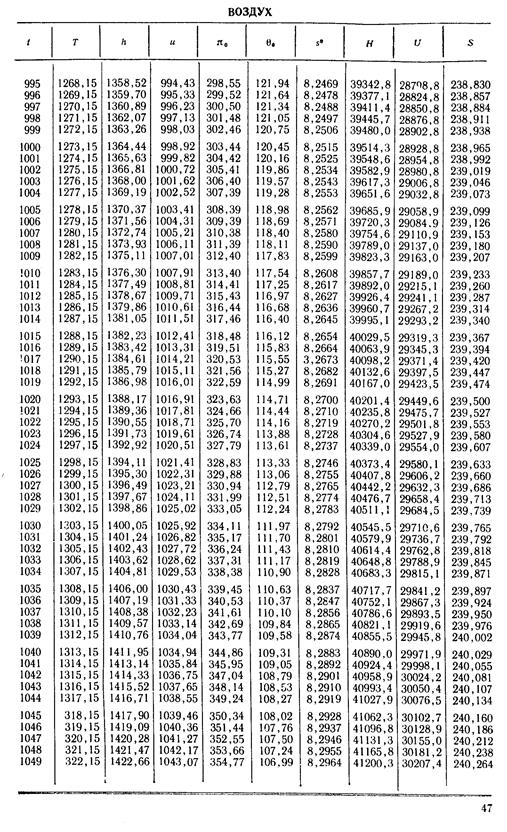
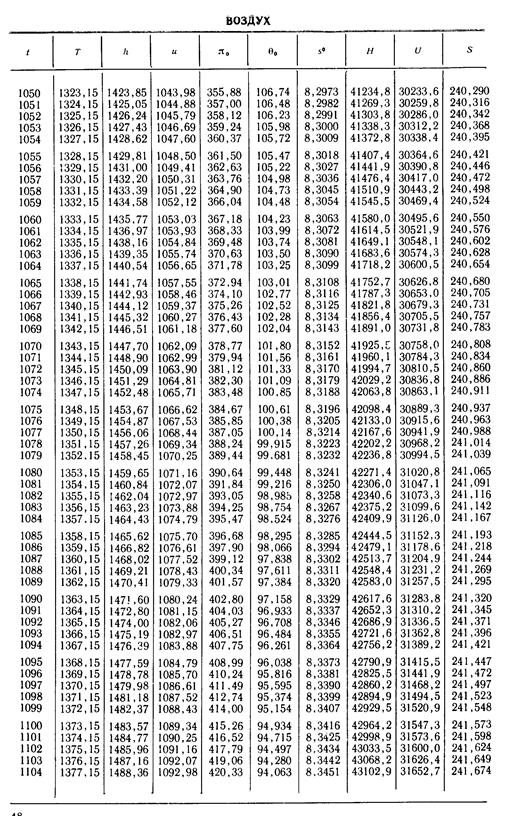
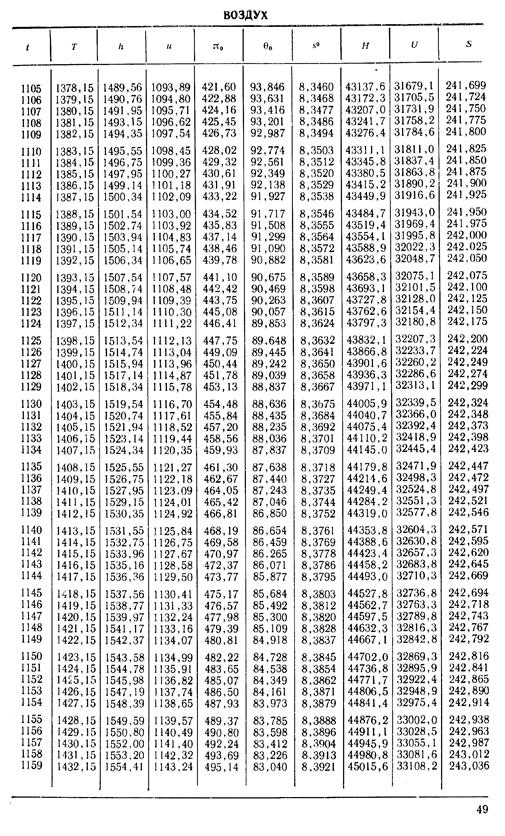
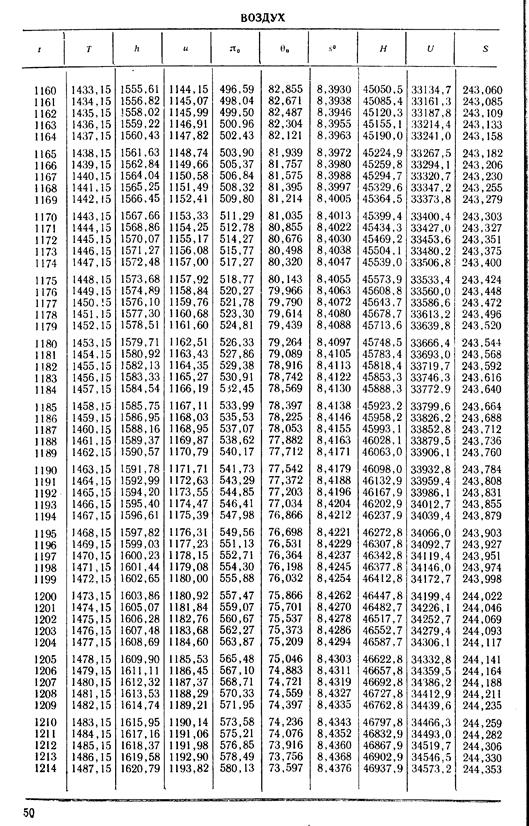
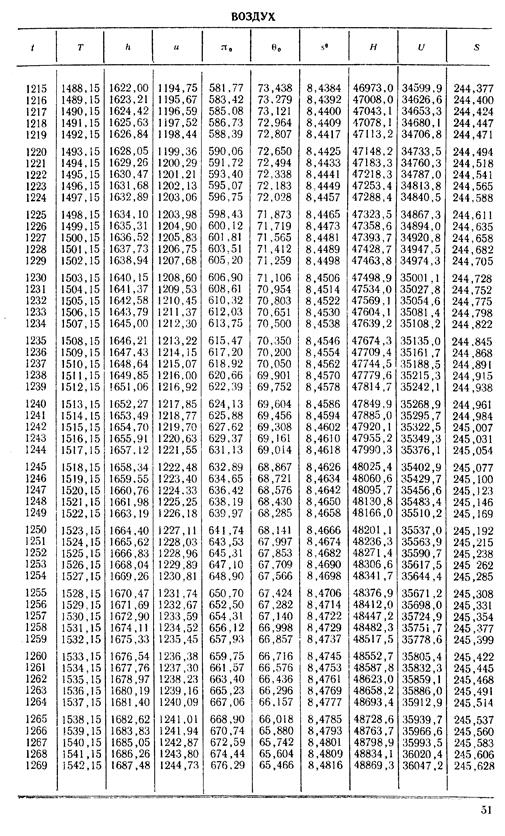
1. По кривой энтальпии µh = H диаграммы находим мольную энтальпию возду
ха, соответствующую температуре t1= 20 °С:
H1 = 8500 кДж/кмоль.
На кривой lgπ0 находим точку igπ01, соответствующую той же температуре.
2.От этой точки вверх откладываем отрезок, соответствующий логарифму степени изменения давления
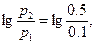
и по горизонтали от конца этого отрезка на-
ходим на кривой lgπ0 значение lgπ02s, на кривой µh=Н — энтальпию H2s, а затем и температуру воздуха в конце адиабатного процесса t2s:
t2s = 190 °С; H2s = 13 480 кДж/кмоль.
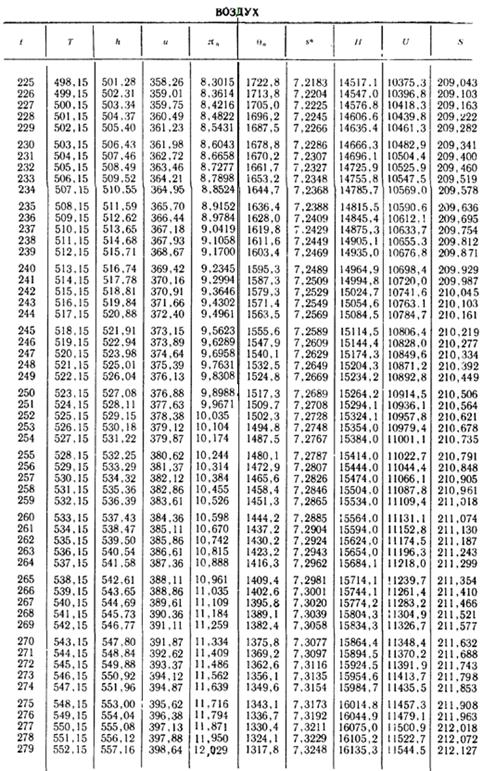
3. Теоретическая работа
DHад = 13 480 — 8500 = 4980 кДж/кг.
4. Энтальпия воздуха в конце действительного процесса при t2=220 °С,
H2 = 14 360 кДж/кмоль.
5. Действительная работа
DHд = 14 360 — 8500 = 5860 кДж/кг.
6. Внутренний относительный КПД процесса сжатия
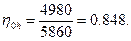
Пример 2. По условиям предыдущего примера определить изменение внутренней энергии воздуха в действительном процессе и мольные объемы воздуха в начале и конце сжатия.
Решение. Изменение внутренней энергии
DU =DH - (µRT2 —µRTi).
По линии µRТ, нанесенной на диаграмму, определим значения µRT2 и µRT1, соответствующие температуре воздуха в конце и начале процесса:
µRT2= 4100 кДж/кмоль;
µRT1= 2450 кДж/кмоль;
DU = 5860 — (4100 — 2450) = 4210 кДж/кмоль.
Мольный объем воздуха, м3/кмоль, в начале процесса сжатия
V1 = µRT1/p1,
и в конце процесса сжатия
V2 = µRT2/ p2
(здесь µRT нужно подставить в Дж/кмоль, а давление — в Па). Мольные объемы:
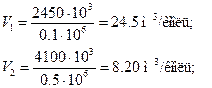
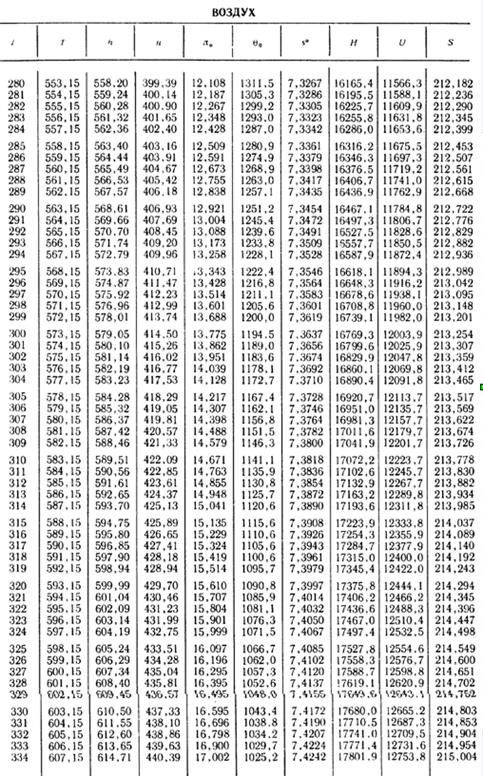
Пример 3. Определить теоретическую работу расширения продукта сгорания газа подземной газификации при α = 7, имеющего температуру t1 = 600 °С при давлении p1=0,7 МПа, если конечное давление р2 равно 0,1 МПа. Найти плотность газа, отнесенную к нормальным условиям, при указанном значении α.
Решение. Ход расчета показан на рис. 4.
По кривой rв определим rв, соответствующее значению α = 7:
rв = 75 %.
Находим на диаграмме кривые µh и lgπ0, соответствующие значению rв, ближайшему к найденному значению; для температуры 600°С находим интерполяцией
H1 = µh = 26 670 кДж/кмоль; lg π01 = 2,870.
От точки lgπ01 вниз откладываем отрезок, равный lg p 1/ p 2 т. е. lg 0,7/0,1, отсчитанный по шкале lgφ.
По горизонтали от конца этого отрезка находим точку lgπ02s = 2,025 и затем находим соответствующие этому значению температуру газа t2s = 253°С в конце расширения и энтальпию газа
H2s = µh2s = 15 560 кДж/кмоль.
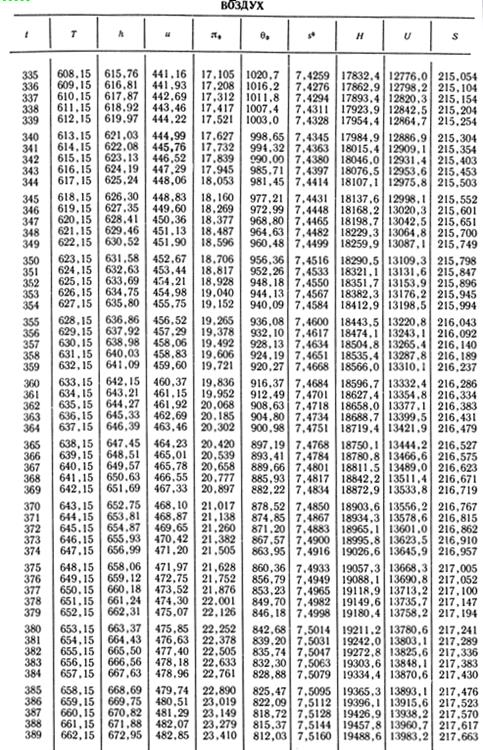
Теоретическая работа расширения моля газа
DHад = Н1 — H2s = 26 670 — 15 560 = 11 110 кДж/кмоль.
Найдем молекулярную массу газа и его плотность, отнесенную к нормальным условиям. По прямым µ и ρ находим для α = 7:
µ = 29,06; ρ= 1,296 кг/м3.
Теоретическая работа расширения 1 кг газа
Dhад= 11 210/29,06 = 385,8 кДж/кг.
Пример 4. По условиям предыдущего примера определить внутренний относительный КПД и изменение энтропии в процессе, если температура в конце действительного процесса расширения t2=305°С.
Решение. Для температуры t2 = 305°C находим энтальпию в конце действительного процесса расширения
Н2 = µh2 = 17 230 кДж/кмоль
и логарифм относительного давления
lg π02 = 2,180.
Тогда действительная работа
DH д= H1 — Н2 = 26 670 — 17230 = 9440 кДж/кмоль,
а КПД
η0h = 9440/11110 = 0,850.
Изменение энтропии определится по найденным значениям lgπ0 следующим образом;
S2 — S1 = µs2 — µs1 = 19,144 (lg π02 — lg π02s) =
= 19,144 (2,180 — 2,025) = 19,144 • 0,155 = 2,967 кДж/(кмоль-К)
СПИСОК ЛИТЕРАТУРЫ
1. Ривкин С. Л. Таблицы термодинамических свойств газов. М.—Л.: Госэнергоиздат, 1953.
2. Ривкин С. Л. Термодинамические свойства газов. — М.: Энергия, 1964.
3. Литвин А. М. Техническая термодинамика. — М.—Л.: Госэнергоиздат, 1958, 1963.
4. Сборник задач по технической термодинамике / Т. И. Андрианова, Б. В. Дзам-пов, В. Н. Зубарев, С. А. Ремизов. — М.: Энергия, 1971.
5. Калафати Д. Д. Анализ методов расчета адиабатного процесса смеси газов по таблицам и диаграммам. Изв. вузов. Сер. Энергетика, 1965, № 8.
6. Ривкив С. Л. Термодинамические свойства воздуха и продуктов сгорания топ-лив. — М.—Л.: Госэнергоиздат, 1954, 1962.
7. Ривкин С. Л. Термодинамические свойства газов. — М: Энергия, 1973.
[1] При посроении диаграммы удобнее по шкале lgπ0 отложить значения lgπ0-9
[2] Поскольку lnπ0=s0/R,описываемая диаграмма эквивалентна Т, S-диаграмме для моля идеального газа.
 2015-10-13
2015-10-13 2543
2543