Кристаллизация идет с достаточной скоростью лишь в пересыщенных растворах. В пересыщенном растворе в первый - инкубационный -период образуются зародыши кристаллов. Начало и скорость образования зародышей в растворе зависит от степени пересыщения, природы растворенного вещества и растворителя, наличия нерастворимой твердой фазы, действия электрического поля и других факторов.
Причиной возникновения зародышей кристаллов в растворах является флуктуация концентраций, в результате чего образуются «дозародыши» кристаллов, представляющие собой скопления молекул или ионов растворенного вещества. «Дозародыши» могут быстро образовываться под действием теплового движения молекул раствора. В случае столкновения друг с другом такие скопления либо распадаются, либо укрупняются. Когда при укрупнении размер «дозародышей» достигает некоторой критической величины, образуются зародыши кристаллов. Начиная с некоторого критического размера rКР, составляющего 0,5-5 нм, начинается быстрый рост зародышей и образование большого числа кристаллов различного размера. Чем меньше критический размер кристалла rКР, тем
больше должна быть степень пересыщения раствора. Эта закономерность выражается следующим уравнением:
|
|
|
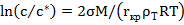 (23.11)
(23.11)
где с-концентрация раствора в момент начала кристаллизации, кг/м3; с*- равновесная растворимость, кг/м3;  - поверхностное натяжение, Н/м; М- молекулярная масса кристаллов;
- поверхностное натяжение, Н/м; М- молекулярная масса кристаллов; 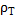 , плотность кристаллов.
, плотность кристаллов.
Величина с/с* называется степенью пересыщения. На стадии роста кристаллов происходит образование крупных кристаллов за счет массообмена с жидкой фазой. Стадии образования зародышей и роста кристаллов могут проходить быстрее при увеличении степени пересыщения, при более высокой температуре, при интенсивном перемешивании и добавке нерастворимых твердых частиц («затравки»).
Скорость увеличения массы каждого из кристаллов при их росте зависит от интенсивности внешнего массообмена и скорости включения молекул растворенного вещесгва в кристаллическую решетку. Скорость подвода вещества к поверхности кристалла описывается уравнением массоотдачи
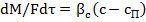 (23.12)
(23.12)
где М масса кристаллической фазы, кг; Р (- коэффициент массоотдачи в жидкой (сплошной) фазе; с- концентрация вещества в объеме раствора, кг/м3; 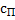 - концентрация вещества у поверхности кристалла, кг/м3.
- концентрация вещества у поверхности кристалла, кг/м3.
Если скорость прироста массы кристаллов велика, то общую скорость процесса кристаллизации можно определять по уравнению (23.12), так как в этом случае основное сопротивление процессу (т. е. лимитирующая стадия процесса) будет сосредоточена в фазе раствора. Скорость прироста массы кристалла (или встраивания молекул в кристалл) может быть описана следующим выражением:
|
|
|
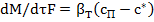 (23.13)
(23.13)
где 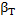 - коэффициент массоотдачи в твердой (дисперсной) фазе; с*- концентрация насыщения.
- коэффициент массоотдачи в твердой (дисперсной) фазе; с*- концентрация насыщения.
По уравнению (23.13) можно определять общую скорость процесса кристаллизации, если скорость подвода вещества к поверхности кристалла велика, т.е. в этом случае лимитирующей стадией процесса является скорость прироста массы кристалла. В случае соизмеримых скоростей процессов в сплошной и дисперсной (твердой) фазах общая скорость процесса может быть определена по уравнению массопередачи [при сопоставлении выражений (23.12) и (23.13) ]:
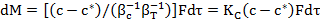 (23.14)
(23.14)
где 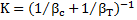 - коэффициент массопередачи.
- коэффициент массопередачи.
Использование уравнения (23.14) для расчета скорости процесса кристаллизации затруднено тем, что отсутствуют обобщенные зависимости для определения значений Кс. Кроме того, часто зависимость скорости процесса прироста массы кристалла [уравнение (23.13)] от движущей силы (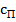 - с*) оказывается нелинейной.
- с*) оказывается нелинейной.
В диффузионной области, когда общая скорость процесса описывается уравнением массоотдачи (23.12) при 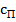 = с* кристаллизация существенно ускоряется при возрастании значений параметров, уменьшающих толщину диффузионного пограничного слоя: скорости потока, частоты вращения мешалки, коэффициента молекулярной диффузии и снижения вязкости среды, иначе говоря при увеличении значений критерия Рейнольдса и диффузионного критерия Прандтля.
= с* кристаллизация существенно ускоряется при возрастании значений параметров, уменьшающих толщину диффузионного пограничного слоя: скорости потока, частоты вращения мешалки, коэффициента молекулярной диффузии и снижения вязкости среды, иначе говоря при увеличении значений критерия Рейнольдса и диффузионного критерия Прандтля.
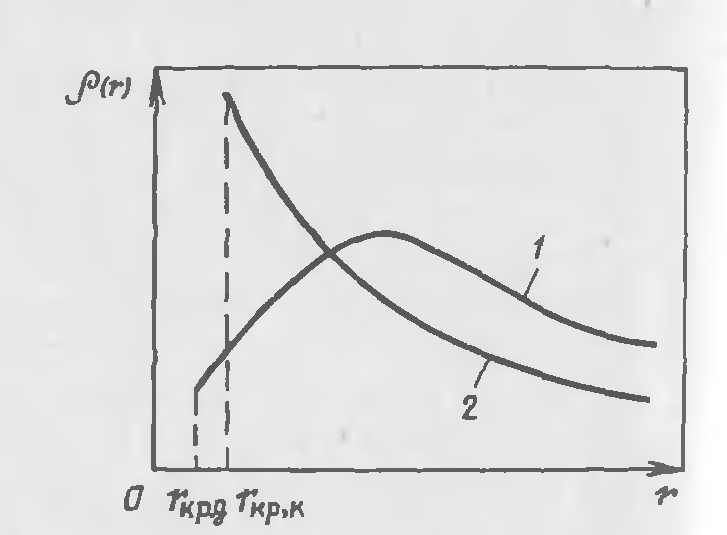
Рис. 23-3. Плотность распределения кристаллов по размерам:
1- в диффузионной области (Nu 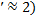 ; 2- в кинетической области при постоянной скорости роста кристаллов.
; 2- в кинетической области при постоянной скорости роста кристаллов.
Возрастание температуры также увеличивает скорость образования кристаллов под влиянием снижения вязкости среды и минимального критического размера кристалла [уравнение (23.11)], после достижения которого начинается массовая кристаллизация.
Соотношение скорости образования зародышей и их роста определяет конечный размер кристаллов. Увеличение температуры кристаллизации, скорости перемешивания и степени пересыщения уменьшает средний размер образующихся кристаллов, поскольку скорость образования зародышей в этих случаях увеличивается быстрее, чем скорость наращивания массы кристаллов.
Быстрое охлаждение раствора и малая молекулярная масса растворенного вещества также способствуют получению более мелких кристаллов. Чем меньше получаемые кристаллы, тем меньше они содержат примесей. Недостатком мелкокристаллического продукта является трудность его отделения от раствора.
Распределение кристаллов по размерам может быть весьма разнообразным. Кроме упомянутых выше факторов, влияющих на средний размер кристаллов, распределение частиц по размерам зависит от структуры потоков в аппарате (т.е. от распределения частиц по времени пребывания в аппарате), и от того, какая стадия массопереноса определяет скорость процесса кристаллизации.
В качестве примера на рис. 23-3 представлены дифференциальные функции распределения кристаллов по размерам [р (r)] в аппарате полного смешения в диффузионной области (кривая 1), когда скорость определяется внешним массообменом (при Nu 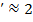 ), и в кинетической области (кривая 2), когда скорость роста кристалла лимитируется скоростью включения молекул в кристаллическую решетку и не зависит от размера кристалла.
), и в кинетической области (кривая 2), когда скорость роста кристалла лимитируется скоростью включения молекул в кристаллическую решетку и не зависит от размера кристалла.
Помимо рассмотренной -диффузионной- модели процесса кристаллизации известны и другие модели, например поверхностного натяжения, адсорбционная, дислокационная, сущность которых описывается в специальной литературе.
 2015-10-14
2015-10-14 2587
2587
