Modèles approchés couramment employés
Le modèle des sphères dures
Le modèle le plus simple pour représenter un atome est une boule indéformable. Ce modèle est très utilisé en cristallographie. Une molécule peut se voir comme plusieurs boules accolées, un cristal comme des boules empilées. On utilise parfois une représentation «éclatée»: les atomes sont représentés comme des petites boules espacées, reliées par des traits, permettant de faire ressortir les directions privilégiées, les angles et de visualiser le nombre des liaisons.
 modèle des sphères dures pour représenter l'atome; représentation d'une molécule d'eau et d'un cristal cubique à faces centrées, compacte (gauche) et éclatée (à droite)
modèle des sphères dures pour représenter l'atome; représentation d'une molécule d'eau et d'un cristal cubique à faces centrées, compacte (gauche) et éclatée (à droite)
Ce modèle correspond bien à certaines propriétés de la matière, comme par exemple la difficulté de comprimer les liquides et les solides, ou bien le fait que les cristaux ont des faces bien lisses. En revanche, il ne permet pas d'expliquer d'autres propriétés, comme la forme des molécules: si les atomes n'ont pas de direction privilégiée, comment expliquer que les liaisons chimiques révèlent des angles bien définis?
Le modèle de Bohr
Un modèle a été développé par Niels Bohr en 1913 à partir des propriétés mises en évidence par Planck et Rutherford. Dans le modèle des sphères dures, l'atome est un objet entier, indécomposable. Or, on sait depuis le milieu du XIXe siècle que l'on peut en «arracher» des particules portant une charge électrique négative, les électrons. Dans le modèle de Bohr, l'atome est composé d'un noyau chargé positivement, et d'électrons tournant autour, les rayons des orbites des électrons ne pouvant prendre que des valeurs bien précises.
Modèle de l'atome de Bohr:
un modèle planétaire dans lequel
les électrons ont des orbites définies
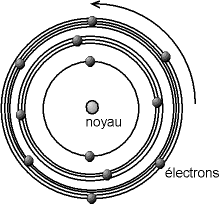 Le noyau est très compact, d'un diamètre d'environs 10-15 à 10-14 m, c'est-à-dire que le noyau est cent mille à un million de fois plus petit que l'atome; il porte une charge électrique positive. C'est aussi la partie la plus lourde de l'atome, puisque le noyau représente au moins 99,95% de la masse de l'atome. Les électrons sont ponctuels, c'est-à-dire que leur rayon est admis quasi nul (tout du moins plus petit que ce que l'on peut estimer). Ils portent une charge négative. Pour des raisons de lisibilité, le schéma ci-dessous n'est donc pas à l'échelle, en ce qui concerne les dimensions du noyau et des électrons, ni aussi pour les rayons des différentes orbites (on notera ici que le nombre d'électrons sur les orbites n'est pas prédit par le modèle).
Le noyau est très compact, d'un diamètre d'environs 10-15 à 10-14 m, c'est-à-dire que le noyau est cent mille à un million de fois plus petit que l'atome; il porte une charge électrique positive. C'est aussi la partie la plus lourde de l'atome, puisque le noyau représente au moins 99,95% de la masse de l'atome. Les électrons sont ponctuels, c'est-à-dire que leur rayon est admis quasi nul (tout du moins plus petit que ce que l'on peut estimer). Ils portent une charge négative. Pour des raisons de lisibilité, le schéma ci-dessous n'est donc pas à l'échelle, en ce qui concerne les dimensions du noyau et des électrons, ni aussi pour les rayons des différentes orbites (on notera ici que le nombre d'électrons sur les orbites n'est pas prédit par le modèle).
Cette vision permet de décrire les phénomènes spectroscopiques fondamentaux, c'est-à-dire le fait que les atomes absorbent ou émettent seulement certaines longueurs d'onde (ou couleur) de lumière ou de rayons X. En effet, les électrons ne pouvant tourner que sur des orbites définies, le saut d'une orbite à une autre se fait en absorbant ou en émettant une quantité déterminée d'énergie (quantum).
Le modèle de Bohr, décomposant l'atome en deux parties, un noyau et un nuage d'électrons, est plus précis que le modèle des sphères dures, pour lequel la surface de la sphère correspond à l'orbite des électrons extérieurs.
Cependant, il présente le gros inconvénient des modèles planétaires: des électrons en orbite autour du noyau sont des charges accélérées, ils devraient rayonner de l'énergie,… et devraient donc venir s'écraser sur le noyau. Le modèle n'explique pas non plus la forme des molécules.
 2015-10-14
2015-10-14 365
365








