Контрольная работа
164. Согласно реакции Кучерова.
CH3 - C≡CH + H2O → CH3 – C(O) – CH3 [Hg2+, H+]
пропин ацетон
CH3 – C(O) – CH3 + СН3 – СН2 – МgBr → СH3 – CH2 – C(CH3)2 – O – MgBr
ацетон реактив Гриньяра
СH3 – CH2 – C(CH3)2 – O – MgBr + H2O → СH3 – CH2 – C(CH3)2– OH + Mg(OH)Br
2-метилбутанол-2
СH3 – CH2 – C(CH3)2– OH → CH3 – CH = C(CH3)2 + H2O [NH4Cl]
2-метилбутен-2
152.
Этиленгликоль – простейший двухатомный спирт
НО-CH2 – CH2-OH
Для этиленгликоля характерны типичные реакции одноатомных спиртов.
Активное взаимодействие с щелочными металлами:
2НО-CH2 – CH2-OH + 2Na → 2НО-CH2 – CH2-ONa + H2↑
Реакции образования эфиров:
НО-CH2 – CH2-OH + OH – CH3 → НО - CH2 – CH2- O – CH3 + H2O
Взаимодействие с хлороводородом:
НО-CH2 – CH2-OH + HCl → НО-CH2 – CH2-Cl + H2O
Кислотность этиленгликоля выше, чем у одноатомных спиртов. Специфической реакцией является качественная реакция с гидроксидом меди (II).

156.
Протекание дегидратации зависит от условий ее проведения.
Внутримолекулярная дегидратация с образованием пропена:
CH3 – CH2 – CH2 –OH → CH3 – CH = CH2 + H2O (H2SO4, t > 150ºC)
|
|
|
Межмолекулярная дегидратация с образованием дипропилового эфира:
2 CH3 – CH2 – CH2 –OH → CH3 – CH2 – CH2 – O – CH2 – CH2 – CH3 + H2O
(H2SO4, t < 150ºC)
Механизм реакции дегидратации спиртов
Протонирование спиртов в ненуклеофильной среде приводит к дегидратации, которая происходит при нагревании спирта в концентрированной серной. Катион алкоксония, отщепляя воду, образует нестабильный соединение - карбокатион, который теряет протон с образованием алкена. Наиболее медленная стадия всего процесса - превращение катиона алкоксония в карбокатион. Концентрированная H2SO4 связывают выделяющуюся воду, что делает весь процесс необратимым.

158.
Температура кипения в ряду этиловый спирт, этиленгликоль, глицерин значительно возрастает в связи с ростом числа гидроксильных групп в молекуле спиртов. Чем больше гидроксильных групп в молекуле, тем больше число водородных связей возникает между молекулами спирта. Чем больше водородных связей способны образовывать между собой молекулы спирта, тем больше нужно затратить энергии на разрыв этих связей. Это приводит к росту температуры кипения.
Характерные реакции глицерина:
Реакция с гидроксидом меди (II):
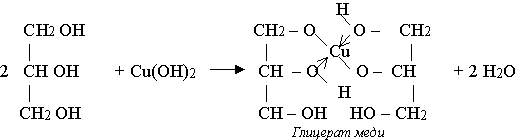
Взаимодействие с активными металлами:

Образование сложных эфиров с карбоновыми кислотами (жиры):

185.
CH3 – C(O) – CH3 + H2 → CH3 – CH(OH) – CH3
ацетон пропанол-2
CH3 – CH(OH) – CH3 → CH3 – CH = CH2 + H2O (H2SO4)
пропанол-2 пропен
CH3 – CH = CH2 + CO + H2 → CH3 – CH2 – CH2 – CH = O [kat = Co(CO4)]
пропен бутаналь
CH3 – CH2 – CH2 – CH = O + H2N – CH2 – CH3 → CH3 – CH2 – CH2 – CH = N– CH2 – CH3 + H2O
(бутилэтиламин)
177.
а) Альдольно-кротоновая конденсация ацетальдегида (уксусный альдегид). При действии разбавленных растворов щелочей в холоде на уксусный альдегид происходит образование альдоля. При проведении реакции в более жестких условиях (при нагревании) происходит дегидратация альдоля в кротоновый альдегид:
|
|
|
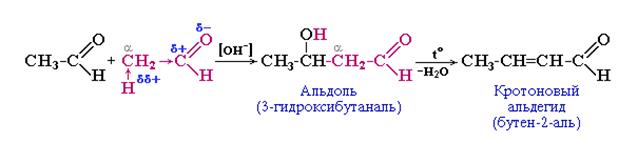
б) Альдольно-кротоновая конденсация бутанона-2. При катализе щелочью у бутанона-2 происходит отщепление протона от метильной группы:

г) Аналогично протеканию конденсации у ацетальдегида происходит альдольно-кротоновая конденсация пропионового альдегида:

Механизм альдольной конденсации. При действии основания в карбонильном соединении отщепляется протон из α-положения и образуется карбанион (I), в котором отрицательный заряд делокализован при участии карбонильной группы.

Анион (I) представляет собой сильный нуклеофил, который присоединяется ко второй (неионизированной) молекуле карбонильного соединения. В результате такого взаимодействия возникает новая связь С-С и образуется промежуточный алкоксид-ион (II). В водной среде этот анион стабилизируется, отщепляя протон от молекулы воды, и превращается в конечный продукт - альдоль.

196.
OH – CH2 – CH2 – OH + 2HBr → Br – CH2 – CH2 – Br + 2H2O
этиленгликоль этилендибромид
Br – CH2 – CH2 – Br + 2KOH → CH ≡ CH + 2KBr + 2H2O
CH ≡ CH + H2O → CH3 – CH = O [Hg2+]
уксусный альдегид
CH3 – CH = O + [H] → CH3 – CH2 – OH
этиловый спирт
CH3 – CH2 – OH → СH2 = CH2 + H2O (H2SO4, t ºC)
этен
СH2 = CH2 + HBr → СH3 – CH2 – Br
бромэтан
СH3 – CH2 – Br + NaCN = СH3 – CH2 – CN + NaBr
пропаннитрил
171.
Химические свойства альдегидов на примере соединения 2-метилпропаналь.
CH3 – CH2 – CH2 – CH(CH3) – CH = O
1) Нуклеофильное присоединение по двойной связи С = O
CH3 – CH2 – CH2 – CH(CH3) – CH = O + HCN →
CH3 – CH2 – CH2 – CH(CH3) – CH(OH) – CN [KCN]
2) Гидрирование
CH3 – CH2 – CH2 – CH(CH3) – CH = O + H2 →
CH3 – CH2 – CH2 – CH(CH3) – CH2 – OH [LiAlH4]
3) Реакция «серебряного зеркала»
CH3 – CH2 – CH2 – CH(CH3) – CH = O +2[Ag(NH3)2]OH →
CH3 – CH2 – CH2 – CH(CH3) – COONH4 + 2Ag + 3NH3 + H2O
Альдегиды очень легко окисляются в карбоновую кислоту и ее соли – качественная реакция на альдегиды.
4) Присоединение реактива Гриньяра
CH3 – CH2 – CH2 – CH(CH3) – CH = O + СH3 – Mg – Br + H2O→
CH3 – CH2 – CH2 – CH(CH3) – CH(CH3) – OH + Mg(OH)Br
 2015-10-22
2015-10-22 7465
7465






