По степени диссоциации электролиты делят условно на две группы сильные и слабые.
Сильные – которые в водных растворах полностью диссоциируют на ионы.
Слабые – не полностью диссоциируют, т.е. часть в виде молекул, часть в виде ионов.
| a > 30% | a < 3% |
| 1. HCl, HBr, HI, НNО3, H2SO4, НСlО4, НСlО3, Н2СrО4, Н2Сг2О7, НМnО4 2. Все щелочи 3. Почти все растворимые соли | 1. HF, H2S, HCN, Н3ВО3, Н2СО3, H2SiO3, HNO2, H3PO4, Н2НРО3,, HClO2, HClO 2. Нерастворимые основания + NH4OH 3. Некоторые соли ZnCl2, HgCl2 |
Степень диссоциации электролитов зависит от природы электролита и растворителя, от температуры и концентрации раствора. Она увеличивается при растворении и нагревании.
Для характеристики слабых электролитов применяют константу диссоциации (константа равновесия для процесса диссоциации). Слабые электролиты диссоциируют на ионы не полностью, в их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами.
Так, для процесса диссоциации уксусной кислоты:
СН3СООН 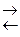 Н+ + СН3СОО–
Н+ + СН3СОО–
|
|
|
Константа равновесия

Константа диссоциации зависит от природы диссоциирующих веществ и растворителя, от температуры, и не зависит от концентрации раствора. Чем больше константа диссоциации, тем легче электролит распадается на ионы, тем больше ионов в его растворе и тем сильнее электролит.
 (СН3СООН) = 1,8×10–5
(СН3СООН) = 1,8×10–5
 (НСN) = 8×10–10 Видно, что уксусная кислота более сильная.
(НСN) = 8×10–10 Видно, что уксусная кислота более сильная.
 2017-10-25
2017-10-25 200
200








