| Типы гибридизации АО | КЧ | Пространственные формы комплексов | Комплексообразователи | Примеры |
| sp | линейная | Ag+, Hg2+ | [Ag(NH3)2]+ | |
| sp3 | тетраэдрическая | Be2+, Fe2+, Co2+, Zn2+ | [Cu(NH3)4]2+ | |
| sp2d | квадратная | Pt2+, Au3+, Cu2+, Ni2+ | [AuCl4]- | |
| sp3d2 (или d2sp3) | октаэдрическая | Fe2+, Fe3+, Ni2+, Pt4+, Co3+ | [Ni(NH3)6]2+ [Co(NH3)6]3+ |
Соединения с координационным числом 6 имеют октаэдрическую структуру. Для нее характерна sp3d2 - гибридизация. Если в гибридизации участвуют d- орбитали уровня (n-1), ее называют “внутриорбитальной” и выражают формулой (n-1)d2nsnp3. А в случае участия d-орбиталей уровня n – “внешнеорбитальной” - nsnp3nd2. Критерием для определения типа гибридизации служат опытные данные о магнитных свойствах комплексов.
Внутриорбитальные комплексы диамагнитны, т.к. не содержат неспаренных электронов. Их называют низкоспиновыми. Внешнеорбитальные комплексы парамагнитны, т.к. содержат неспаренные электроны. Их относят к высокоспиновым.
Рассмотрим строение двух комплексов:
[NiCl6]4-
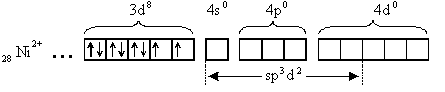

Тип гибридизации sp d - внешнеорбитальный. Комплекс парамагнитен, высокоспиновый, имеет октаэдрическую форму.
|
|
|
[Co(NH3)6]3+
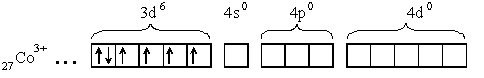
Под действием лигандов происходит спаривание d- электронов и молекулы аммиака поступают на освободившиеся d- орбитали и на свободные s- и p- орбитали иона кобальта:
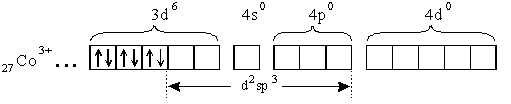
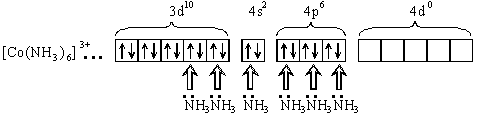
Тип гибридизации d2sp3 - внутриорбитальный. Комплекс диамагнитен, низкоспиновый, имеет октаэдрическую форму.
 2018-01-21
2018-01-21 4907
4907
