Раствор как гомогенная система. Растворитель, растворенное вещество. Классификация растворов по степени дисперсности, по растворимости в воде, по способности к диссоциации.
Раствор - находящаяся в состоянии равновесия гомогенная система переменного состава из двух или более веществ.
Под переменным составом раствора понимают то простое обстоятельство, что соотношение смешанных друг с другом веществ может непрерывно изменяться в определенных пределах.
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. (В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает)
Любой раствор состоит из растворенных веществ и растворителя. Вещества, составляющие раствор, называются компонентами раствора.
Растворенное вещество — Компонент жидкого или твердого раствора, который присутствует в меньшем или незначительном количестве; компонент растворяется в Растворителе.
Классификация растворов
по растворимости в воде:
В лабораторной практике различают концентрированные растворы (содержание растворенного вещества соизмеримо с содержанием растворителя) и разбавленные растворы (содержание растворенного вещества мало по сравнению с содержанием растворителя).
А ниже это уже про растворимость веществ, не нужно здесь.
P - хорошо растворимые (более 1,0 г на 100 г воды);
M - малорастворимые (0,1 г - 1,0 г на 100 г воды);
Н - нерастворимые (менее 0,1 г на 100 г воды).
по способности к диссоциации:
По наличию или отсутствию электролитической диссоциации растворы НМС подразделяют на три класса - растворы электролитов, неэлектролитов.
Растворы электролитов - растворы диссоциирующих на ионы солей, кислот и оснований. Электропроводность растворов электролитов выше, чем растворителя. Например, растворы KNO3, НCl, KOH.
Растворы неэлектролитов - растворы веществ, практически не диссоциирующих в воде. Например, растворы сахарозы, глюкозы, мочевины. Электропроводность растворов неэлектролитов мало отличается от растворителя.
по степени дисперсности:
| Грубодисперсные системы (взвеси) | Коллоидные системы (кровь, лимфа, слюна, белки) | Истинные растворы (раствор соли в воде) |
| Размер частиц дисперсной фазы | ||
| Больше 100 нм 10–7–10 –5 м | 1-100 нм 10–9–10–7 | меньше 1 нм |
На всякий случай.
I. Взвеси – это дисперсные системы, в которых размеры распределённых частиц сравнительно велики (10–7–10 –5 м). Взвеси делятся на суспезии и эмульсии; в первых распределённое вещество твёрдое, во вторых – жидкое. Частицы взвеси видны простым глазом или в обычный оптический микроскоп. Взвеси – системы мутные и непрозрачные. Взвеси неустойчивы, частицы диспергированного вещества выпадают в осадок (песок + вода), а если плотность диспергированного вещества меньше плотности среды, то диспергированное вещество всплывает (глина + масло). Процесс разделения взвесей называется седиментацией (для суспензий) и расслоением(для эмульсий).
II. Коллоидные системы – это такие дисперсные системы, в которых частицы распределённого вещества имеют размеры порядка 10–9–10–7 м. Каждая такая частица может содержать большое число атомов или молекул. Такие частицы невидимы через обычный микроскоп, но видимы в ультрамикроскоп, где свет падает сбоку или сзади, в результате чего в поле зрения видны светлые точки, возникающие в результате рассеяния света диспергированными частицами.
III. Истинные растворы или просто растворы – это дисперсные системы, в которых диспергированное вещество распределено в среде в виде молекул или ионов; частицы имеют размеры порядка 10–10–10–7 м. Растворы системы однородные, устойчивые.
Способ выражении концентрации растворов: массовая доля вещества в растворе, молярная концентрация, молярная концентрация эквивалента(или нормальная концентрация), массовая концентрация или титр.
Концентрацией вещества называют величину, измеряемую количеством растворенного вещества, содержащегося в определенной массе или объеме раствора или растворителя.
1. Массовая доля (ω) - отношение массы соответствующего компонента в растворе к общей массе этого раствора. Выражается в единицах или процентах.
ω (х)= 

Численно массовая доля равна числу граммов вещества, растворенного в 100г раствора.
2. Молярная концентрация (См) - отношение количества растворенного вещества к объему раствора. Численно (См) равна количеству молей растворенного вещества, содержащегося в 1 л. раствора). Выражается она в моль/л. Сокращенно пишут М. Например, 2М (NaOH).
См= 
1моль/л = 1М раствор – одномолярный раствор (в 1 л раствора содержится 1 моль растворенного вещества);
0,1М – децимолярный раствор;
0,01М – сантимолярный раствор;
0,001М – милимолярный раствор.
3. Нормальная концентрация (молярная концентрация эквивалента, СN)- количество моль- эквивалентов вещества, содержащегося в 1 л раствора.
СN= 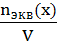
Единица измерения моль-экв/л, Сокращенно обозначается буквой N. Например, 0.1N HCL означает, что в 1 литре такого раствора содержится 0,1моль- эквивалент НСl.
3. Массовая концентрация или титр раствора T(Х) измеряют в кг/см^3, г/см^3, г/мл,
Титр (Т) - масса растворенного вещества, содержащаяся в 1 мл раствора, выраженная в граммах. Определятся по формуле:
Т= СN·Мэкв/1000
Раствор с известным титром называется титрованным раствором.
 2018-01-21
2018-01-21 11803
11803