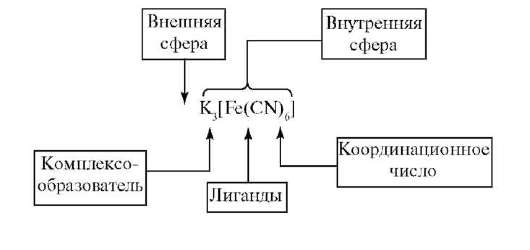
Комплексными соединениями называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью,которых является наличие центрального атома, окруженного лигандами.
По координационной теории Вернера в комплексном соединении различаютвнутреннюю и внешнюю сферы. Центральный атом с окружающими его лигандами образуют внутреннюю сферу комплекса.Между центральным атомом и лигандами действуют силы притяжения (образуется ковалентная связь по обменному и (или) донорно-акцепторному механизму), между лигандами - силы отталкивания. Все остальное в комплексном соединении составляет внешнюю сферу и пишется за квадратнымискобками.
В соответствии с зарядом внутренней сферы комплексные соединения подразделяются на нейтральные:
Катионные:
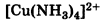
Анионные:
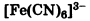
Лиганды - ионы или молекулы, которые непосредственно связаны с комплексообразователем и являются донорами электронных пар. Эти электроноизбыточные системы, имеющие свободные и подвижные электронные пары, могут быть донорами электронов.
|
|
|
Комплексообразователь (центральный атом) – атом или ион, который является акцептором электронных пар, предоставляя свободные атомные орбитали, и занимает центральное положение в комплексном соединении.
Число свободных атомных орбиталей, предоставляемых комплексообразователем, определяет его координационное число. Обычно оно равно удвоенному заряду комплексообразователя.
Эффективность и прочность донорно-акцкпторного взаимодействия лиганда и комплексообразователя определяется их поляризуемостью-способностью частицы трансформировать свои электронные оболочки под внешним воздействием.
[Cr(H2O)5Cl]Cl2.=0 - нейтральный комплекс
Cr(H2O)5Cl=2+
Cr(H2O)5 =3+
(H2O)5 =0, то степень окисления у хрома = +3
Координационное число хрома – 6
[Pt(NH3)2Cl4] = 2- - анионный комплекс
(NH3)2 = 0
Pt = 2+
Координационное число платины - 4
Cl4 = 4-
Наиболее прочная связь образуется между жесткой кислотой (ЖК) и жестким основанием (ЖО), мягкой кислотой (МК) и мягким основанием (МО).
Металлы жизни (биометаллы) – ЖК и кислоты средней жесткости (d-элементы). Металлы токсиканты – МК.
Белки, включая ферменты, содержат мягкие легкополяризуемые группы: --СОО-, --NH2, --SH, поэтому биометаллы (ЖК) образуют с ними непрочные комплексы. Катионы тяжелых металлов Cd2+, Pb2+, Hg2+ сильно токсичны, они являются мягкими кислотами, поэтому активно образуют прочные комплексы с жизненно важными белоксодержащими субстратами, нарушая их метаболизм.
Склонностью к комплексообразованию объясняется также токсичность цианидов, т.к. анион CN- - очень мягкий лиганд – активно взаимодействует с катионами d-металлов в комплексах, замещая в них биосубстраты и тем самым инактивируя эти биокомплексы.
|
|
|
В растворах комплексные соединения могут подвергаться первичной и вторичной диссоциации.
Первичная диссоциация - распад комплексного соединения в растворе на комплексный ион внутренней сферы и ионы внешней сферы.
Вторичная диссоциация комплексного соединения – это распад внутренней сферы на составляющие ее компоненты.
Этот процесс протекает по типу слабых электролитов, так как частицы внутренней сферы связаны неионогенно (ковалентной связью). Диссоциация носит ступенчатый характер.
Для качественной характеристики устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную ее диссоциацию, называемую константой нестойкости комплекса (Кн). Для комплексного аниона [Ag(CN)2]- выражение константы нестойкости имеет вид:
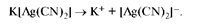
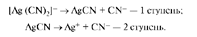
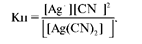
Чем меньшеКн, тем комплекс прочнее.
Величина, обратная константе нестойкости, называется константой устойчивости:
Ку = 1/Кн = [Ag(CN)2]- / [Ag+][CN]2
Используя значения констант нестойкости комплексных частиц, можно рассчитать концентрацию свободных ионов металла в растворе (точнее – аквакомплексов).
Наиболее прочный ион тот, чья константа нестойкости ниже.
Kн = [Fe(3+)][CN(-)]^6 / [Fe(CN)6(3-)]
Дентатность – число донорных атомов в лиганде, характеризующих его координационную емкость.
По числу связей, образуемых лигандом с комплексообразователем, лиганды делятся н моно-, би- и полидентатные.
- монодентатные – содержат один донорный атом, образуют одну связь:
F-, Cl-, CN- и т.д.
- бидентатные – содержат два донорных атома, могут занять два координационных места:
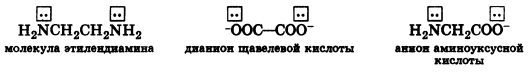
- полидентатные:
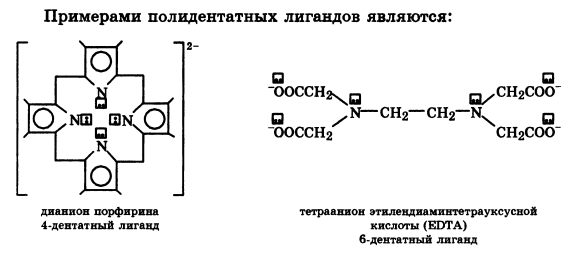
Вода-монодентатныйлиганд. Щав.К-та-бидентатный, аминоуксусная – бидентатный
Металлоферменты — общее собирательное название класса ферментов, для функционирования которых необходимо присутствие катионов тех или иных металлов (Mn, Fe, Cu, Zn, Mo).
В металлоферментах ионы металлов формируют каталитически активнуюконформацию структуры фермента. В большинстве случаев возникают напряженные нестабильные структуры ионов металлов с донорными атомами азота или кислорода боковых цепей остатков аминокислот.
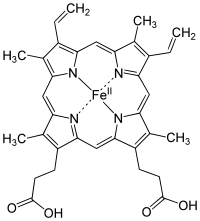
1. Гемоглобин –включает четыре гема, соединенные четырьмя глобиновыми цепями. В молекуле 4 фрагмента – α1, α2, ß1, ß2. Каждый из которых способен к замещению лабильного лигандаH2O на молекулу О2, в результате образуется оксигемоглобин.
Гем – плоский, жесткий макроцикл, относится к группе металлопорфиринов, хелатобразующийлиганд, тетрадентатныйпорфин (порфин содержит 4 остатка молекулы пиррола, соединенных метиленовыми группами, сопряженную систему двойных связей) в координационной сфере Fe (II):
- 4 места заняты атомами Nпорфирина
- пятое место занимает атом боковой цепи гистидина, связывающий гем с молекулой глобина
- шестое – вакантное место, его может занимать молекула H2Oвгемоглобине, и молекула О2 оксигемоглобине
Витамин В12
B12 имеет сложную химическую структуру, основой которой является корриновое кольцо.
- коррин во многом похож на порфирин (сложная химическая структура, входящая в состав гема, хлорофилла и цитохромов), но отличается от порфирина тем, что два пиррольных цикла в составе коррина соединены между собой непосредственно, а не метиленовым мостиком.
- в центре корриновой структуры располагается ион кобальта:
- четыре координационных связи кобальт образует с атомами азота
- ещё одна координационная связь соединяет кобальт с диметилбензимидазольным нуклеотидом
- последняя, шестая координационная связь кобальта остаётся свободной: именно по этой связи и присоединяется цианогруппа, гидроксильная группа и т.д. 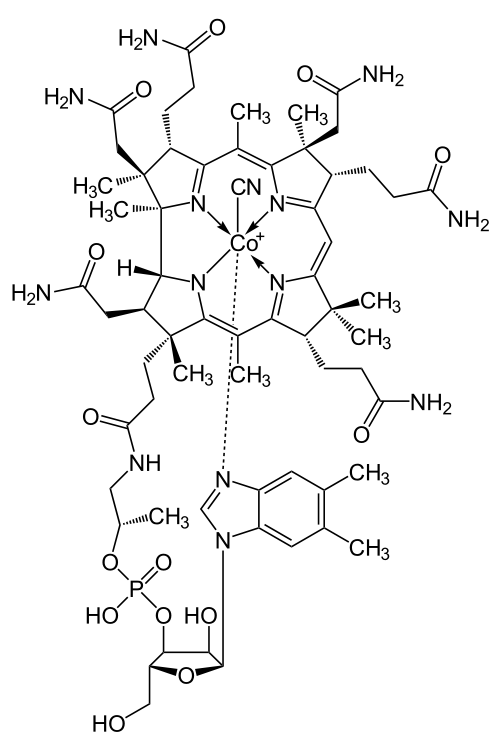
|
|
|
Хелаты – устойчивые комплексы металлов с полидентатнымилигандами, в которых центральный атом является компонентом циклической структуры.
Хелатотерапия – это выведение токсичных частиц из организма, основанное на хелатировании их комплексонами s–элементов.
Выведение ионов-токсикантов из организма наиболее эффективно под действием хелатирующих реагентов. Хелатные комплексы являются более прочными, чем обычные комплексы с монодентатной или бидентатной координацией.
Препараты, применяемые для выведения инкорпорированных в организме токсичных частиц, называют детоксикантами.
Унитиол: Британский антилюизитон(БАЛ)
H2C-SH H2C-SH
HC-SH HC-SH
H2C-SO6Na H2C-SH
Выводят из организма As, Hg, Bi.
ЭДТА и его производные используют при почечно-каменной болезни и при отравлении тяжелыми металлами. При больших дозах ЭДТА связывает иона Са2+ (происходит обызвествление).
Пентацин (CaNa3ДТПА) – применяют при отравлении радиоактивными элементами.
Тетациин (Na2CaЭДТА) – при отравлении Pb, Hg, Cd. Его рекомнедуют принимать с витамином В12, т.к. он может связывать ионы Fe2+.
Принципы хелатотерапии
1. Детоксикант (лиганд-антидот) должен эффективно связывать ионы-токсиканты, т.е вновь образовавшиеся соединения должны быть прочнее ранее существовавших.
2. Детоксикант не должен разрушать жизненно важные соединения, т.е вещества, которые могут образоваться при соединении детоксиканта и иона биометалла должны быть менее прочными, чем существующие в организме.
Трилонометрия -титриметрический метод анализа, основанный на реакциях взаимодействия комплексонов, катионами щелочноземельных и тяжелых металлов.
Титрант: растворы 0,1; 0,05 или 0,02 моль/дм3 трилона Б.
Индикатор: эриохром черный Т
Условия комплексонометрическоro титрования:
1.Реакции комплексообразования должны протекать быстро. Константа нестойкости образующихся комплексов должна быть малой величиной.
2.Определяемые ионы должны образовывать с металлоиндиктором менее прочные комплексы, чем их комплексы с трилоном Б.
|
|
|
3.Комплексонометрическое титрование следует проводить при определенном значении рН (рН < 10).
Наиболее ценным свойством трилона Б является его способность образовывать очень устойчивые комплексы с катионами большинства металлов, при этом реакция всегда протекает в соотношении 1:1, и с вытеснением двух протонов, независимо от заряда катиона металла:
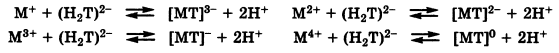
Для установления точки эквивалентности в комплексонометрии применяют метллоиндикаторы:
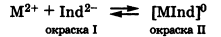
При добавлении к окрашенному раствору трилона Б он сначала реагирует со свободными ионами анализируемого металла с образованием бесцветного комплекса [МТ]2- и вблизи состояния эквивалентности происходит разрушение комплекса с индикатором [МInd]:
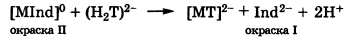
 2018-01-21
2018-01-21 5088
5088