Так как Ag2SO4 и CaSO4 разнотипные электролиты (Ag2SO4 – трехионный, CaSO4 – двухионный), то для сравнения их растворимости используют величину – молярная растворимость S.
Ag2SO4 ↔ 2Ag+ + SO4 2-
S 2S S
C (Ag+) = 2S (Ag2SO4)
C (SO4 2-) = S (Ag2SO4)
Ks (Ag2SO4) = C^2 (Ag+) * C (SO4 2-) = (2S)^2 * S = 4S^3
S =  = 1,65*10^-2 моль/л
= 1,65*10^-2 моль/л
CaSO4 ↔ Ca2+ + SO4 2-
S SS
Ks(CaSO4) = S*S = S^2
S =  = 0,49*10^-2 моль/л
= 0,49*10^-2 моль/л
S (Ag2SO4) > S (CaSO4)
Осадок образуется из пересыщенного раствора. Условием образования осадка является превышение произведения концентрации ионов малорастворимого сильного электролита (Пс) над величиной Кs
Пс =cm(An+) cn(Bm–)>Кs
Присутствие в биологических жидкостях большого числа ионов приводит к тому, что одновременно могут образовываться несколько малорастворимых электролитов.
1. Последовательность осаждения двух и более малорастворимых сильных электролитов определяется не величиной Ks, а равновесными концентрациями ионов над осадком, которые вычисляют из Ks. В первую очередь образуется осадок того малорастворимого сильного электролита, для достижения константы растворимости которого концентрация одноименного иона будет меньше (правило последовательности образования осадков)
2. Для достижения полноты осаждения одного вида ионов малорастворимого сильного электролита необходимо увеличить концентрацию другого вида ионов этого электролита(правило достижения полноты осаждения ионов)
Растворение осадка или сдвиг равновесия вправо может быть осуществлен с помощью любого метода уменьшения концентрации свободных ионов An+ или Bm–:
1) связыванием этих ионов в другой менее растворимый осадок,
2) связыванием ионов металла в комплекс,
3) связыванием аниона в малодиссоциированную кислоту,
4) окислением или восстановлением катиона или аниона.
Электролиты AgCl, AgBr, AgI – однотипные, поэтому о последовательности образования их осадков судим по величине Ks: чем меньше Ks, тем меньше ионов осадителя требуется для образования осадка и тем он раньше выпадет как менее растворимый.
Ks (AgCl) > Ks (AgBr) > Ks (AgI)
Сначала осаждаться будет AgI, потом AgBr, последним AgCl.
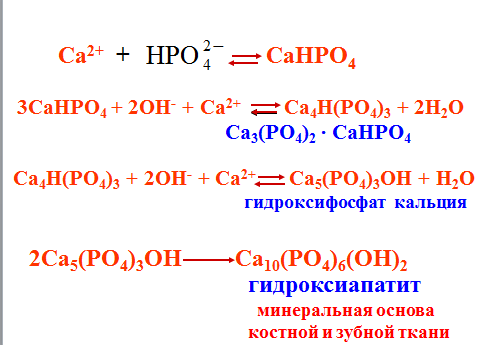
Лимитирующей является стадия образования гидроксиапатита, т.к. его молярная растворимость наименьшая.
1. Образование костной ткани начинается с плазмы крови и включает несколько стадий: При физиологическом значении рН крови (7,4) в системе сосуществуют ионы (30%) и.(70%).
2. Основным минеральным компонентом костной ткани является гидроксифосфат кальция Ca5(PO4)3OH. Часть ионов Ca2+ замещена ионами Mg2+, а очень незначительная часть ионов OH– замещена ионами фтора, которые повышают прочность кости.Клетки костной ткани могут легко ускорять либо отложениелибо растворение минеральных компонентов при локальных изменениях рН, концентрации ионов Са2+ или и комплексообразующих соединений. Так, при увеличении концентрации ионов Са2+ в плазме крови наблюдается сдвиг равновесия, приводящий к отложению кальция в костной ткани. Наоборот, снижение концентрации ионов Са2+ в плазме крови также вызывает сдвиг равновесия, но сопровождающийся уже растворением минеральных компонентов костной ткани. Всасывание кальция из продуктов питания обеспечивается витамином D,
3. Так же на регуляцию обмена ионов кальция и фосфат-ионов влияют паратгормон, кальцитриол (действие гормона направлено на повышение концентрации кальция в плазме крови)
6.
Часть ионов Ca2+ в костной ткани замещена ионами Mg2+. Незначительная часть ионов OH– замещена ионами фтора. Это приводит к уплотнению кристаллической решетки, а следовательно, к увеличению твердости и повышению устойчивости соединения к действию кислот (фторид-ион - менее сильное основание Бренстеда по сравнению с гидроксид-ионом). Явление зътоооооисталлохимические характеристики, называется изоморфизмом.
Таким образом, помимо гидроксиапатита в состав костной ткани входят и другие неорганические минералы:
CaНPO4 2H2O- гидрофосфат кальция (брушит)
Ca5(PO4)3F- фторапатит (в составе зубной эмали)
Ca10(PO4)6СO3 – карбонапатит
Ca8H2 (PO4)6 ∙ 5H2O- октакальция фосфат
Mg10(PO4)6(OH)2
Ca3(PO4)2 – аморфный фосфат кальция
Возможное замещение кальция на близкие ему по свойствам бериллий, стронций, барий в условиях организма строится на явлении изоморфизма (конкуренция катионов за анион) и образовании менее растворимых соединений:
Be5(PO4)3OH, Sr5(PO4)3OH Bа5(PO4)3OH
В организме человека, помимо фосфатов, ионы Са2+ могут образовываться и другие малорастворимые соединения- патологические конкременты. Локально повышение концентрации некоторых ионов может наблюдаться при различных нарушениях обмена веществ.
Мочекаменная болезнь:
- образование уратов кальция (солей мочевой кислоты) при рН<7;
- образование фосфатов кальция при рН>7
Са2+ + РО4 3- → Са3(РО4)2
- при различных рН образование оксалата кальция Са (соль щавелевой кислоты).
Са2+ +  → СаС2О4
→ СаС2О4
Кальциноз сосудов - отложение карбоната кальция на стенках сосудов
Са2+ + СО3 2- → СаСО3
Осаждение — это образование твердого осадка в растворе в ходе химической реакции, например, добавлением соответствующих реагентов.
Сам метод заключается в выделении из раствора химических компонентов в виде малорастворимого соединения.
Осаждения методы — объемные (титриметрические) методы количественного анализа, основанные на использовании химических реакций осаждения, т. е. таких химических процессов, протекающих в растворах, при которых одно из образующихся веществ выпадает в осадок.
Аргентометрический титриметрический метод анализа основан на применении в качестве
осадителя: Аg+ + Наl- ↔ АgНаl↓
При выборе индикатора выбирают такой ион, который образует окрашенное соединение с ионом серебра в пределах скачка титрования, то есть при рАg = 4...6 ед. наиболее пригодным оказывается K2CrО4, т. к. Ks = 2,1 * 10 -12 и анион CrO42- образуют окрашенный 1осадок с ионами серебра при концентрации последних, отвечающих значениям в пределах скачка на кривой титрования.
Ионы Ве2+ вытесняют ионы Са2+ из костной ткани, вызывая ее размягчение, т.к. ионный радиус Ве2+ меньше ионного радиуса Са2+ Это приводит к заболеванию – бериллозу (бериллиевый рахит)..
Стронций поступает в организм вместе с пищей и, несмотря на «дискриминацию» стронция в пользу кальция, часть ионов Sr2+ включается в состав костной ткани, что вызывает ломкость кости (стронциевый рахит). Особую опасность представляет собой изотоп стронций-90 (период полураспада 27,7 года, чистый – излучатель): Оседая в костях, Sr90 облучает красный костный мозг, нарушает кроветворение, что приводит к развитию онкологических заболеваний (лейкемии, саркоме), влияет на наследственность.
Коллоидный CaHPO4, окруженный белками и гидратной оболочкой, вместе с током крови направляется в сторону костной ткани, где в остеобластах происходит конечный этап образования костной ткани - минерализация. Способствующие факторы: рН=8, повышенная концентрация фосфат- ионов, образующихся при гидролизе сложных эфиров фосфорной кислоты, углеводов, аморфного фосфата кальция.
2-я стадия: 3CaHPO4 + 2OH– + Ca2+⇄ Ca4Н(PO4)3 + 2H2O
Са3(РО4)2СаНРО4
3-я стадия: Ca4H(PO4)3 + 2OH– + Ca2+⇄ Ca5(PO4)3ОН + Н2О

Эмаль – это защитная оболочка, покрывающая анатомическую коронку зубов. В разных участках она имеет разную толщину: так, в области бугров она более толстая (до 2.5мм), а у цементно-эмалевого соединения более тонкая.
Твердые ткани зуба состоят из органического, неорганического веществ и воды. По химическому составу эмаль состоит из 96 % неорганических веществ, 1 % органических веществ и 3% воды. Минеральную основу эмали составляют кристаллы апатитов.
Кроме главного — гидроксиапатита (75 %), в эмали содержится карбонатапатит (19 %), хлорапатит (4,4 %), фторапатит (0,66 %). Менее 2 % массы зрелой эмали составляют неапатитные формы.
Основными компонентами эмали являются:
-гидроксиапатит Са10(Р04)в(ОН)2 и
восьмикальциевый фосфат — Са8Н2(Р04)6 х 5Н20.
Молярное отношение Са/Р в гидроксиапатите равно 1,67.

Насыщенные р-ры – термодинамическая устойчивая равновесная система, в которой скорость растворения вещества равна скорости его выделения (осаждения) из раствора:
V раств> V осажд
Ненасыщенные р-ры – термодинамическая устойчивая неравновесная система,
в которой концентрация вещества меньше, чем в насыщенном р – ре:
V раств =V осажд
Пересыщенные р – ры – термодинамическая устойчивая псевдоравновесная система,
в которой концентрация вещества больше, чем в насыщенном р – ре.
V раств<Vвносажд

Если в растворе присутствуют ионы: Ca2+,Sr2+, PO43- будет доминировать процесс осаждения ионов Ca2+, т.к. атомный радиус кальция меньше, чем у стронция.
Особую опасность представляет собой изотоп стронций-90 (период полураспада 27,7 года, чистый – излучатель): Оседая в костях, Sr90 облучает красный костный мозг, нарушает кроветворение, что приводит к развитию онкологических заболеваний (лейкемии, саркоме), влияет на наследственность. Данный процесс называется изоморфизмом.
Термодинамическую систему, свойства которой от точки к точке изменяются скачкообразно, называют гетерогенной. Такая система состоит из нескольких гомогенных частей. Гомогенную часть гетеро-генной системы называют фазой. Каждая фаза характеризуется массой, геометрическими размерами, и, главное, наличием границы раздела, отделяющей ее от других фаз.
Гетерогенными системами являются, например, жидкость-пар, твердый осадок-насыщенный раствор, твердое тело-газ.
Равновесия, которые устанавливаются на границе раздела фаз, называют гетерогенными равновесиями.
В насыщенном растворе малорастворимого сильного электролита при данной температуре произведение молярных концентраций его ионов, возведенных в степени их стехиометрических коэффициентов, есть величина постоянная и называется константой или произведением растворимости.



 2018-01-21
2018-01-21 4149
4149