Тема 9. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Теоретические основы
Понятия окисления и восстановления, окислителя и восстановителя, степени окисления. Расчет степени окисления. Составление уравнений окислительно-восстановительных реакций методом электронного баланса. Классификация окислительно-восстановительных реакций (ОВР).
Задачи 161... 180
Для реакций, протекающих по приведенным схемам, составьте уравнения методом электронного баланса. Для каждой реакции укажите, какое вещество является окислителем, а какое - восстановителем и за счет каких атомов. Определите типы ОВР.
Схемы реакций
161. А1 + КСЮ4 + H2SO4 -» КС1 + A12(SO4)3 + Н2О
K2SeO3 -» K2SeO4 + K2Se
162. Zn + KMnO4 + H2SO4 -> ZnSO4 + MnSO4 + K2SO4 + H2O
KOH + H2O -» PH3 + KH2PO2
163. Al + K2Cr2O7 + H2SO4 -» Cr2(SO4)3 + A12(SO4)3 + K2SO4 + H2O
P2O3 + H2O -» PH3 + H3PO4
164. Fe2O3 + KNO3 + KOH -» K2FeO4 + NO + H2O
HC1O3 -» C1O2 + HC1O4+ H2O
165. H2C2O4 + MnO2 + H2SO4 -» CO2 + MnSO4 + H2O
P + KOH + H2O -» KH2PO2 + PH3
166. Sb+ KC1O4 + H2SO4 -» Sb2(SO4)3 + KC1 + H2O
Те + KOH -» K2TeO4 + K2Te + H2O
167. Mn(NO3)2 + PbO2 + HNO3 -» HMnO4 + Pb(NO3)2 + H2O
As + NaOH -» Na3As + Na3AsO3 + H2O
168. NaAsO2 + 12 + Na2CO3+ H2O -» NaH2AsO4 + Nal + CO2
Cu(NO3)2 -» CuO + NO2 + O2
|
|
|
169. Н2С2О4 + КС1О3 -» К2СО3+ СО2+ СЮ2 + Н2О
NH4NO2-> N2 + H2O
170. Hg + NaNO3+ H2SO4 -»Na2SO4 + HgSO4 + NO + H2O
LiClO3 -» LiCl + O2
171. Na2SO3 + K2Cr2O7 + H2SO4 -> Na2SO4 + Cr2(SO4)3 + K2SO4 + H2O
KMnO4 -> K2MnO4 + MnO2 + O2
172. Na2SeO3 + C12 + NaOH →Na2SeO4 + NaCl + H2O
H2MnO4 → HMnO4 + MnO2+ H2 О
173. Na3AsO3+ K2Cr2O7 + H2SO4 -» Cr2(SO4)3 + Na3AsO4 + K2SO4 + H2O
Br2 + NaOH -»NaBr + NaBrO + H2O
174. SO2 + NaIO3 + H2O -» I2 + Na2SO4+ H2SO4
MnO2 + H2SO4 -» Mn2(SO4)3 + O2+ H2O
175. Na2S2O4 + AgCl + NH4OH -» (NH4)2SO3 + NaCl + Ag + H2O
MnO2->Mn2O3 + O2
176. Ag NO3 + AsH3 + H2O -» Ag + H3AsO4+ HNO3
MnO2 + H2SO4 -» MnSO4 + O2 + H2O
177. Na2SeO3 + C12 + NaOH -»Na2SeO4 + NaCl + H2O
I2+ Ba(OH)2 -> Ba(IO3)2 + BaI2 + H2O
178. MnSO4+ NaBiO3 + HNO3 -» NaMnO4 + Bi (NO3)3 + H2SO4 +NaNO3 + H2O
LiClO3 -» LiClO4 + LiCl
179.Se + AuCl3+ H2O -» Au + H2SeO3 + HCI
MnO2 + NaOH -» MnO(OH) + Na3 MnO4+ H2O
180.PH3+ KMnO4 + H2SO4 -» H3PO4 + MnSO4 +K2SO4 + H2O
KC1O3->KC1 + O2
Тема 10. ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ И ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ
Теоретические основы
Электродные потенциалы. Гальванические элементы. Электродвижущая сила (ЭДС).
Задачи 181... 200
По заданию из табл.7 составьте схему гальванического элемента, напишите электронные уравнения электродных процессов и суммарное уравнение соответствующей окислительно-восстановительной реакции. Вычислите концентрацию раствора электролита (задачи 161...170) или ЭДС (задачи 171...180). Необходимые для решения данные приведены в табл.7 (обозначения "первый электрод" и "второй электрод" не связаны с понятиями "катод" и "анод").
Таблица 8
| Номер задачи | Металл 1-го электрода | Электролит 1-го электрода | Концентрация электролита 1-го электро-да, моль/л | Металл 2-го элек-трода | Электролит 2-го электрода | Концентрация электролита 2-го электрода, моль/л | ЭДС, В |
| РЪ | Pb(N03)2 | 0,10 | Т1 | T1NO3 | ? | 0,180 | |
| № | NiSO4 | 1,00 | In | In2(S04)3 | ? | 0,133 | |
| Zn | ZnSO4 | 0,01 | Zn | ZnSO4 | ? | 0,059 | |
| Ag | AgN03 | 1,00 | Mg | Mg(N03)2 | ? | 3,192 | |
| Hg | HgCl2 | 1,00 | Al | A1C13 | ? | 2,536 | |
| Bi | Bi(N03)3 | 0,10 | Zn | Zn(N03)2 | ? | 0,988 | |
| Fe | FeCl2 | 1,00 | Be | BeCl2 | ? | 1,470 | |
| Cd | Cd(N03)2 | 0,01 | Bi | Bi(N03)3 | ? | 0,677 | |
| Mn | MnSO4 | 0,01 | Cu | CuSO4 | ? | 1,576 | |
| In | In(N03)3 | 0,001 | Ag | AgN03 | ? | 1,201 | |
| Co | Co(NO3)2 | 0,10 | Ag | AgN03 | 0,01 | ? | |
| Mn | Mn(NO3)2 | 1,00 | Tl | T1NO3 | 0,10 | ? | |
| In | In(N03)3 | 0,10 | Ni | Ni(N03)2 | 0,01 | ? | |
| Pb | Pb(N03)2 | 1,00 | Al | A1(N03)3 | 0,001 | ? | |
| Cu | CuCl2 | 0,001 | In | InCl3 | 0,01 | ? | |
| Ag | AgN03 | 1,00 | А1 | A1(N03)3 | 0,001 | ? | |
| Hg | HgCl2 | 0,01 | А1 | А1С13 | 1,00 | ? | |
| Pb | Pb(N03)2 | 0,10 | Т1 | T1NO3 | 0,001 | ? | |
| Bi | Bi(N03)3 | 0,01 | Be | Be(NO3)2 | 1,00 | ? | |
| Cd | CdCl2 | 1,00 | Сг | СгС12 | 0,10 | ? |
|
|
|
Тема 11. КОРРОЗИЯ МЕТАЛЛОВ И СПОСОБЫ ЗАЩИТЫ ОТ НЕЕ
Теоретические основы
Основные виды коррозии. Анодные и катодные процессы при электрохимической коррозии. Кинетика коррозионных процессов. Методы защиты от коррозии.
Задачи 201... 220
201. Как протекает контактная коррозия цинка и кадмия во влажном воздухе? Составьте электронные уравнения анодного и катодного процессов. Какие продукты при этом образуются?
202. В чем различия в коррозии оцинкованного и луженого железа при нарушении целостности покрытий во влажной атмосфере? Приведите электронные уравнения анодного и катодного процессов в обоих случаях. Укажите продукты коррозии.
203. Изделие, изготовленное из стали, эксплуатируется в нейтральном растворе хлорида натрия. Какие металлы можно использовать в качестве протектора? Приведите электронные уравнения анодного и катодного процессов для одного из протекторов.
204. Приведите пример протекторной защиты стального изделия в морской воде. Напишите электронные уравнения анодного и катодного процессов.
205. Два стальных листа скреплены в одном случае алюминиевыми, а в другом - медными заклепками. Как будут происходить процессы коррозии в морской воде в том и другом случаях? Приведите электронные уравнения анодных и катодных процессов.
206. Изделие, изготовленное из свинца, эксплуатируется в нейтральном растворе хлорида калия. Какие металлы можно использовать в качестве протектора? Приведите электронные уравнения анодного и катодного процессов для одного из протекторов.
207. Изделие, составленное из медных и никелевых фрагментов, эксплуатируется в разбавленном растворе хлороводорода. Как будет происходить процесс контактной коррозии? Составьте электронные уравнения анодного и катодного процессов.
208. Металлическая конструкция построена из цинковых деталей, часть которых имеет медные заклепки. Конструкция эксплуатируется в сернокислой среде. Какие из этих деталей быстрее выйдут из строя и почему? Приведите электронные уравнения анодного и катодного процессов.
209. Одно из свинцовых изделий имеет никелевое покрытие, а другое - серебряное покрытие. Как происходит коррозия каждого из них во влажном воздухе при нарушении целостности покрытия? Приведите электронные уравнения анодных и катодных процессов, укажите состав коррозионных продуктов.
210. Две железные скрепки, поверхность одной из которых покрыта никелем, а поверхность другой - цинком, находятся в растворе поваренной соли. Поверхностный слой частично нарушен (на поверхности скрепок имеются царапины). Приведите электронные уравнения анодных и катодных процессов для обоих случаев коррозии, укажите состав коррозионных продуктов.
211. Для защиты от коррозии стальных корабельных винтов в морской воде широко используют цинковые протекторы. Объясните принципиальные основы такой защиты. Приведите электронные уравнения анодного и катодного процессов.
212. Некий конструктор предложил проект яхты, в котором предлагалось подводную часть усилить стальными листами для обеспечения большей прочности, а надводную часть украсить медными листами. Оцените целесообразность такого проекта. Составьте прогноз коррозионной устойчивости такой конструкции в морской воде. Напишите электронные уравнения соответствующих процессов.
|
|
|
213. Объясните механизм защиты подземного стального трубопровода с помощью магниевого протектора, если почвенные воды в данной местности имеют ярко выраженный кислотный характер. Приведите электронные уравнения анодного и катодного процессов.
214. Как протекает контактная коррозия никеля и серебра в хлороводородной кислоте? Составьте электронные уравнения анодного и катодного процессов. Какие продукты при этом образуются?
215. В соляную кислоту опустили две цинковые пластинки, одна из которых частично помеднена. Как происходит коррозия в том и другом случае? Составьте электронные уравнения анодных и катодных процессов. Какие продукты при этом образуются?
216. Как протекает коррозия железа, покрытого свинцом, в случае нарушения покрытия во влажном воздухе? Составьте электронные уравнения анодного и катодного процессов. Какие продукты при этом образуются?
217. Во влажном воздухе находятся две железные пластинки. Часть поверхности одной из них покрыта оловом, а часть поверхности другой - медью. Как происходит коррозия в том и другом случае? Составьте электронные уравнения анодных и катодных процессов. Какие продукты при этом образуются?
218. Как протекает контактная коррозия никеля и серебра во влажном воздухе? Составьте электронные уравнения анодного и катодного процессов. Какие продукты при этом образуются?
219. Как протекает коррозия никелированной меди в случае нарушения покрытия во влажном воздухе? Составьте электронные уравнения анодного и катодного процессов. Какие продукты при этом образуются?
220. В нейтральный раствор электролита, содержащий растворенный кислород, опустили две цинковые пластинки, одна из которых частично помеднена, а вторая - частично амальгамирована. Как происходит коррозия в том и другом случае? Составьте электронные уравнения анодных и катодных процессов.
|
|
|
Тема 12. ЭЛЕКТРОЛИЗ
Теоретические основы
Электролиз как окислительно-восстановительная реакция. Катодные и анодные процессы при электролизе. Закон Фарадея.
Задачи 221... 240
Как будет происходить электролиз водного раствора электролита (табл. 8) при использовании инертных электродов? Приведите уравнение диссоциации электролита и поясните возможность участия каждого из образующихся ионов в электродных реакциях. Составьте электронные уравнения процессов, протекающих на электродах. Вычислите массу (для твердых и жидких) или объем при нормальных условиях (для газообразных) веществ, образующихся на электродах (если на катоде выделяются два вещества, расчет проводите только для металла). Данные, необходимые для решения, приведены в табл. 8 (т - время проведения электролиза, I - сила тока).
Таблица 9
| № задачи | Вещество | т | 1,А |
| K2SO4 | 2ч | ||
| А1С13 | 3 ч 20 мин | ||
| NiSO4 | 35 мин | ||
| HgCl2 | 2 ч 10 мин | ||
| Na2SO4 | 1 ч 15 мин | ||
| AgN03 | 3 ч 40 мин | ||
| CuCl2 | 55 мин | ||
| NiBr2 | 2 ч 15 мин | ||
| MgCl2 | 1ч | ||
| MnI2 | 2 ч 10 мин | ||
| Cu(NO3)2 | 3 ч 15 мин | ||
| FeCl3 | 45 мин | ||
| ZnSO4 | 1 ч 15 мин | ||
| A12(S04)3 | 2 ч 45 мин | ||
| NaCl | 25 мин | ||
| KBr | 2 ч 05 мин | ||
| CaCl2 | 1 ч 25 мин | ||
| MgSO4 | 2 ч 40 мин | ||
| NaNO3 | 45 мин | ||
| Hg(N03)2 | 1 ч 35 мин |
Тема 13 (не делать) Задачи 241...260

ПРИЛОЖЕНИЯ
Приложение 1
Приложение 2 Относительные электроотрицательности элементов
| н | ||||||||
| 2,1 | ||||||||
| Li | Be | В | С | N | О | F | ||
| 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | ||
| Na | Mg | Al | Si | P | S | Cl | ||
| 0,9 | 1,2 | 1,5 | 1,8 | 2,1 | 2,5 | 3,0 | ||
| К | Ca | Ga | Ge | AS | Se | Br | ||
| 0,8 | 1,0 | 1,6 | 1,8 | 2,0 | 2,4 | 2,8 | ||
| Rb | Sr | In | Sn | Sb | Те | I | ||
| 0,8 | 0,9 | 1,7 | 1,8 | 1,9 | 2,1 | 2,5 | ||
| Cs | Ba | Tl | Pb | Bi | Po | At | ||
| 0,7 | 0,9 | 1,8 | 1,9 | 1,9 | 2,0 | 2,2 | ||
Приложение 3
Константы диссоциации некоторых слабых электролитов(25  С)
С)
| Название электролита | Формула | Константа диссоциации |
| Азотистая кислота | 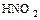
| 
|
| Сернистая кислота | 
| 

|
| Сероводородная кислота | 
| 

|
| Угольная кислота | 
| 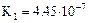

|
| Уксусная кислота | 
| 
|
| Фосфорная кислота | 
| 


|
| Гидроксид аммония | 
| 
|
| Гидроксид цинка | 
| 
|
| Гидроксидмагния | Mg(OH)2 | 
|
| Щавелевая кислота | 
| 

|
Приложение 4 Стандартные электродные потенциалы  некоторых металлов в водных растворах при 298К
некоторых металлов в водных растворах при 298К
| Электрод |  ,B ,B
| Электрод |  ,B ,B
| Электрод |  ,B ,B
|
| Li+, Li | -3,045 | A13+, Al | -1,662 | Ni2+, Ni | -0,250 |
| Rb+,Rb | -2,925 | Mn2+, Mn | -1,180 | Sn2+, Sn | -0,136 |
| К+,К | -2,925 | Cr2*, Cr | -0,913 | Pb2+, Pb | -0,126 |
| Cs+, Cs | -2,923 | Zn2+, Zn | -0,763 | Fe3+, Fe | -0,036 |
| Ra2+, Ra | -2,916 | Cr3+, Cr | -0,740 | H+,H2 | 0,000 |
| Ba2+, Ba | -2,906 | Fe2+, Fe | -0,440 | Bi3+,Bi | +0,215 |
| Ca2+, Ca | -2,866 | Cd2+, Cd | -0,403 | Cu2+, Cu | +0,337 |
| Na+, Na | -2,714 | In3+,In | -0,343 | Ag+, Ag | +0,799 |
| Mg2+, Mg | -2,363 | Tl+, Tl | -0,336 | Hg2+, Hg | +0,854 |
| Be2+, Be | -1,850 | Co2+, Co | -0,277 | Au3+,Au | +1,498 |
Приложение 5
Термодинамические свойства некоторых веществ
| Вещество | ΔH°f; 298°, кДж/моль | S° 298°, Дж/(К-моль) | Вещество | ΔH°f; 298°, кДж/моль | S° 298°, Дж/(К-моль) |
| Вr2(г) | 30,91 | 245,37 | НВr(г) | -36,38 | 198,58 |
| С(ТВ) | 0,00 | 5,74 | НСНО(г) | -115,90 | 218,78 |
| Сd | 0,00 | 51,76 | НJ(г) | 26,36 | 206,48 |
| CdO(TB) | -258,99 | 54,81 | Н2(г) | 0,00 | 130,52 |
| СН3СНО(г) | -166,00 | 264,20 | Н20(г) | -241,81 | 188,72 |
| СН4(г) | -74,85 | 186,27 | Н2О2(г) | -135,88 | 234,41 |
| C102(r) | 104,60 | 257,02 | J(г) | 62,43 | 260,60 |
| С12(г) | 0,00 | 222,98 | N0(r) | 91,26 | 210,64 |
| СО(г) | -110,53 | 197,55 | NOBr(r) | 81,84 | 272,63 |
| СОС12(г) | -219,50 | 283,64 | NOCl(r) | 52,59 | 263,50 |
| С02(г) | -393,51 | 213,66 | N02(r) | 34,19 | 240,06 |
| С2С14(г) | 19,61 | 340,92 | N2(r) | 0,00 | 191,50 |
| С2С16(г) | 27,13 | 398,52 | N20(r) | 82,01 | 219,83 |
| Fe(TB) | 0,00 | 27,15 | N205(r) | 13,30 | 355,65 |
| FeCl2(TB) | -341,01 | 119,66 | 02(г) | 0,00 | 205,04 |
| F2(r) | 0,00 | 202,67 | О3(г) | 142,26 | 238,82 |
Приложение 6
Названия важнейших кислот и их кислотных остатков
| Кислота | Кислотный остаток | ||
| Формула | Название | Формула | Название |
| HF | Фтороводородная (плавиковая) | F- | Фторид |
| HCl | Хлороводородная (соляная) | Cl- | Хлорид |
| HBr | Бромоводородная | Br- | Бромид |
| HI | Иодоводородная | I- | Иодид |
| H2S | Сероводородная | HS- | Гидросульфид |
| S2- | Сульфид | ||
| HClO4 | Хлорная | ClO4- | Перхлорат |
| HClO3 | Хлорноватая | ClO3- | Хлорат |
| HClO2 | Хлористая | ClO2- | Хлорит |
| HClO | Хлорноватистая | ClO- | Гипохлорит |
| H2SO4 | Серная | HSO4- | Гидросульфат |
| SO42- | Сульфат | ||
| H2SO3 | Сернистая | HSO3- | Гидросульфит |
| SO32- | Сульфит | ||
| HNO3 | Азотная | NO3- | Нитрат |
| HNO2 | Азотистая | NO2- | Нитрит |
| HPO3 | Метафосфорная | PO3- | Метафосфат |
| H3PO4 | (Орто)фосфорная | H2PO4- | Дигидрофосфат |
| HPO42- | Гидрофосфат | ||
| PO43- | (Орто)фосфат | ||
| H4P2O7 | Дифосфорная (пирофосфорная) | H3P2O7- | Тригидродифосфат |
| H2P2O72- | Дигидродифосфат | ||
| HP2O73- | Гидродифосфат | ||
| P2O74- | Дифосфат | ||
| H2CO3 | Угольная | HCO3- | Гидрокарбонат |
| CO32- | Карбонат | ||
| H2SiO3 | Кремниевая | HSiO3- | Гидросиликат |
| SiO32- | Силикат | ||
| H3BO3 | Борная | H2BO3- | Дигидроборат |
| HBO32- | Гидроборат | ||
| BO33- | Борат | ||
| H2CrO4 | Хромовая | HCrO4- | Гидрохромат |
| CrO42- | Хромат | ||
| H2Cr2O7 | Дихромовая | HCr2O7- | Гидродихромат |
| Cr2O72- | Дихромат | ||
| HMnO4 | Марганцевая | MnO4- | Перманганат |
| CH3COOH | Уксусная | CH3COO- | Ацетат |
| HCN | Циановодородная (синильная) | CN- | Цианид |
 2017-10-25
2017-10-25 1435
1435







