Алкены
Алкенами, или олефинами, называются углеводороды, в молекулах которых имеется одна двойная связь С=С.
Общая формула СnH2n
Изомерия:
1) Углеродной цепи
2) Положения кратной связи
3) Геометрическая(цис-транс)
4) Межклассовая(с циклоалканами)
Строение молекулы
Молекула этилена С2Н4
· Атомы С- в состоянии sp2-гибридизации
· δ-связи находятся в одной плоскости, валентый угол 120°
· негибридизованныеp-орбитали образуют π-связь
· π-связьрасположенаперпендикулярно плоскости, образованной δ-связями, и является плоскостью симметрии молекулы

Физические свойства
С2-С4 при обычных условиях газы
С5-С15 – жидкости
С16 и далее – твердые вещества
Все алкены легче воды и нерастворимы в ней, пары в смеси с воздухом взрывоопасны
Способы получения
1. Дегидрирование алканов (отщепление водорода)
Осуществляют нагреванием в присутствии никелевого или платинового катализаторов
2. Дегалогенирование (отщепление галогенов)
Осуществляют перегонкой дигалогеналкана с цинковой пылью (дигалогеналкан + Zn)
|
|
|
3. Дегидратация (отщепление воды)
Осуществляют нагреванием спиртов при температурах выше
140 °С в присутствии катализаторов (концентрированной серной или фосфорной кислот, оксида алюминия и некоторых других)
Для гомологов этилена соблюдается правило Зайцева: при отщеплении воды и галогеноводородов атом водорода преимущественно отщепляется от соседнего с соединенным с заместителем атома углерода, имеющего наименьшее число атомов водорода
4. Дегидрогалогенирование (отщепление галогеноводорода)
Осуществляют нагреванием галогеналкана со спиртовым раствором щелочи (NaOH или KOH)
5. Гидрирование алкинов (присоединение водорода)
Реакции присоединения галогеноводорода или воды пойдут против правила Марковникова, если в качестве катализатора использовать H2O2.
Либо у атома углерода стоят сильные заместители такие, как фтор, хлор, нитрогруппа и тд.


Химические свойства
В химических реакциях π-связь легко разрывается, поэтому алкенам характерны реакции присоединения различных веществ: водорода, галогенов, галогеналканов, воды.
Присоединение происходит по правилу В.В.Марковникова: атом водорода преимущественно присоединяется к тому из атомов углерода, образующих кратную связь, который имеет больше атомов водорода; атом галогена или гидроксогруппа присоединяется ко второму из атомов углерода, соединенных кратной связью.
Продукты гидратации -спирты
Окисление алкеновразбавл. Нейтральным KMnO4 или H2O2 приводит к образованию гликолей (диолов); при использовании конц. растворов KMnO4 подкисленного, K2Cr2O7,K2Cr2O7 происходит окислением с разрывом углеродной цепи и образуется смесь кислот или смеси кислот и кетонов.
|
|
|
При каталитическом окислении можно получить альдегид
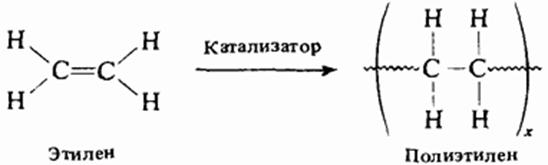
Алкены легко вступают в реакции полимеризации.
Качественные реакции на кратные связи - обесцвечивание раствора брома (бромной воды) или йода и раствора KMnO4.
Реакции присоединения:
· Водорода
· Галогенов
· Воды
· Галогеноводородов
Реакции окисления
· Горение (с образованием СО2 и Н2О)
· Взаимодействие с растворами окислителей KMnO4 подкисленного, K2Cr2O7,K2Cr2O7, Н2О2
Реакции полимеризации
Полимерами, или высокомолекулярными соединениями, называются вещества, молекулы которых состоят из большого числа повторяющихся группировок атомов.
Повторяющаяся группировка атомов – структурное звено, их число - степень полимеризации (n в формуле полимера)
 2018-02-14
2018-02-14 410
410






