Выполнение работы. Определить направление окислительно-восстановительной реакции:
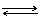 Cr2(SО4)3 + K2SO4 +I2 +H2О К2 Сr2О7 + KI + Н2О.
Cr2(SО4)3 + K2SO4 +I2 +H2О К2 Сr2О7 + KI + Н2О.
Внести в пробирку по 2—3 капли сульфата хрома (III) и сульфата калия и добавить к ним 1—2 капли йодной воды. Происходит ли окисление хрома (III) йодом, которое должно сопровождаться обесцвечиванием йода?
В другую пробирку внести по нескольку капель раствора дихромата калия и серной кислоты, затем добавить 3- 4 капли йодида калий.Почему раствор окрасился в коричневый цвет? В прямом или обратном направлении протекает данная окислительно-восстановительная реакция?
Запись данных опыта. Составить уравнения полуреакций окисления и восстановления для протекающей окислительно-восстановительной реакции. Рассмотреть данную реакцию как процесс, протекающий при работе гальванического элемента. Выписать значения соответствующих электродных потенциалов и вычислить э. д. с. Отметить положительное значение э. д. с. для протекающего окислительно-восстановительного процесса, а также тот факт, что окислителем является окисленная форма гальванической пары, имеющая более высокий электродный потенциал, а восстановителем — восстановленная форма пары с меньшим потенциалом.
|
|
|
Пользуясь электродными потенциалами, решить вопрос, возможна ли при стандартных условиях реакция
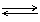

 MnO4 + Вг2 + Н+ Мn2+ + BrO3 + Н20
MnO4 + Вг2 + Н+ Мn2+ + BrO3 + Н20
Ответ мотивировать.
Опыт 5. Образование гальванических пар при химических процессах
 2018-02-13
2018-02-13 344
344








