Введение
Все возрастающее значение комплексных соединений в различных областях теоретического и практического применения диктует настоятельную необходимость их глубокого и всестороннего изучения.
Подразделение всех химических соединений на так называемые простые (атомные) и комплексные (молекулярные), наметилось после создания учения о валентности и внедрения в химию структурных представлений А.М. Бутлерова. Основоположником учения о комплексных соединениях является А. Вернер, он разделил все вещества на два типа: соединения первого порядка (простые соединения) и соединения высшего порядка (продукты взаимного сочетания соединений первого порядка), к ним он относил комплексные соединения. Другие крупные специалисты в данной области (Л.А. Чугаев, П. Прейффер и др.) определяют комплексные соединения как продукты сочетания молекул соединений первого порядка. Все же это определение отнюдь не является безупречным.
Понятие комплекса в растворе до сих пор не получило точного определения. Сегодня мы знаем, что комплексная частица может диссоциировать, и по константе диссоциации можно судить об ее устойчивости. Правда, комплексы в растворе не характеризуются высокой степенью диссоциации, как сильные электролиты, и далеко не всегда комплексная частица бывает соединением высшего порядка. И, наконец, известно, что не существует никаких принципиальных различий между "обычными" и "координационными" связями.
|
|
|
После всего сказанного очевидно, что безупречного определения понятия комплексное соединение существовать не может. Но так как все же желательно дать хотя бы приближенное определение понятия, то можно остановиться на следующем.
Комплексные соединения - это частицы, которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем (центральным атомом или металлоцентром), нейтральных молекул или других ионов, называемых лигандами.
Явление комплексообразования лежит в основе целого ряда биологических процессов, каталитических реакций, электролитического осаждения. Особенно велико значение комплексных соединений в растворах, поскольку в широком смысле можно считать, что химия растворов - это химия комплексных соединений. Д.И. Менделеев указывал на роль химического взаимодействия между компонентами в растворе: "Все формы взаимодействия в растворе, а следовательно, и равновесие в нем, связаны прежде всего с химической природой как растворителя, так и растворенных в нем веществ".
В связи с изложенным, представляется интересным изучение комплексных соединений.
|
|
|
Степени окисления, электронные конфигурации, координационные числа и геометрия соединений хрома
Следуя общим тенденциям заполнения d-подуровня при движении по периоду для элементов VI группы нужно было бы предположить конфигурацию валентных электронов в основном состоянии (n-1) d4ns2. В атоме хрома выигрыш энергии, вызванный стабилизацией наполовину заполненного подуровня и полным отсутствием дестабилизирующего вклада энергии спаривания, оказывается больше энергии, которую необходимо затратить на переход одного из s-электронов на d-подуровень. Это приводит к "перескоку" ("провалу") электрона, т.к известно, что электроны с параллельными спинами испытывают меньшее взаимное отталкивание, чем электроны с противоположными спинами, разность энергий у хрома достигает своего максимума - 3d54s1 (3d44s2). [1]
В различных соединениях хром проявляет степени окисления от - 4 до +6.
| Степень окисления | Электронная конфигурация | Координационное число | Геометрия | Примеры соединений |
| -4 | d10 | 4 | Тетраэдр | Na4 [Cr (CO) 4] |
| -2 | d8 | 5 | Тригональная бипирамида | Na2 [Cr (CO) 5] |
| -1 | d7 | 6 | Октаэдр | Na2 [Cr2 (CO) 10] |
| 0 | d6 | 6 | Октаэдр | Cr (CO) 6, [Cr (CO) 5I] - |
| +1 | d5 | 6 | Октаэдр | K3 [Cr (CN) 5NO], [Cr ({C5H4N}2) 3] + или [Cr (dipy) 3] + |
| +2 | d4 | 4 | Плоский квадрат Октаэдр | Cr (CH3COCHCOCH3) 2 или Cr (acac) [2]2 K4 [Cr (CN) 6], CrF2 |
| +3 | d3 | 4 6 | Тетраэдр Октаэдр | [CrCl4] - [Cr (NH3) 6] 3+ |
| +4 | d2 | 6 | Октаэдр | K2 [CrF6] |
| +5 | d1 | 6 | Октаэдр | K2 [CrOCl5] |
| +6 | d0 | 4 | Тетраэдр Октаэдр | CrO42- CrF6 |
Хром (II)
Известно много соединений хрома (II), все они сильные и быстродействующие восстановители. Водные растворы, содержащие ион Cr2+, имеют небесно-голубой цвет. Этот ион очень легко окисляется Cr3+ + ē → Cr2+ (Е°= - 0,41 В). Легко окисляются кислородом воздуха: 4 [Cr (H2O) 6] 2++O2+4H+=4 [Cr (H2O) 6] 3++2H2O. Будет восстанавливать воду с выделением водорода, причем скорость разложения зависит от кислотности раствора. Высокоспиновые[3] октаэдрические комплексы характеризуются большим магнитным моментом (4,7 - 4,9 μВ[4]). Это свидетельствует о тетрагональном искажении, которое является следствием эффекта Яна-Теллера[5] и вызвано наличием одного электрона на eg -орбитали, что приводит к геометрическому искажению и понижению симметрии d4 -комплексов: два аксиальных лиганда находятся на большем расстоянии от атома Cr (II), чем четыре экваториальных. Такая структура обусловливает склонность высокоспиновых комплексов к гидролизу. Помимо аквакомплексов ([Cr (H2O) 4 (OH) 2; [Cr (H2O) 6] 2+) к высокоспиновым относятся ацетилацетонат (Cr (acac) 2), а также аммиакаты ([Cr (NH3) 5Cl] Cl, [Cr (NH3) 6] Cl2).
Низкоспиновые комплексы хром (II) образует с лигандами сильного поля, например с цианидом K4 [Cr (CN) 6]. Эти комплексы интенсивно окрашены, их магнитный момент составляет 2,74-3,40 μВ, а связь Cr-L характеризуется существенной долей π-связывания.
Так же для хрома (II) известны и кластерные соединения, простейшее из них - ацетат хрома (II) Cr2 (CH3COO) 4 (H2O) 2, выпадающий красный осадок при действии на CrII ацетатов, либо уксусной кислоты:
2CrCl2+4NaCH3COO+2H2O= [Cr2 (H2O) 2 (CH3COO) 4] ↓+4NaCl
На наличие связи Cr-Cr указывает диамагнетизм этого соединения: в нем нет неспаренных электронов. Поскольку каждый ион Cr2+ содержит четыре неспаренных электрона, связь имеет кратность 4. Именно поэтому расстояние Cr-Cr в ацетате (0,230 нм) оказывается короче, чем в металлическом хроме (0,256 нм). Атомы хрома соединены друг с другом также четырьмя бидентатными мостиковыми ацетатными группами. Координационную сферу каждого атома хрома дополняет молекула воды.
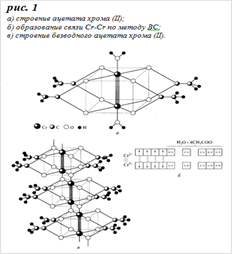
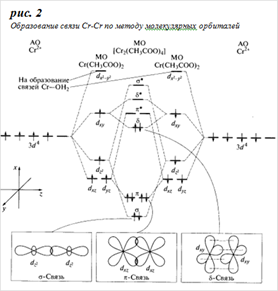
По методу валентных связей (ВС) четырехкратная связь Cr-Cr образуется в результате объединения неспаренных 3d - электронов двух ионов хрома в четыре электронные пары, принадлежащие совместно обоим атомам. Вакантные орбитали ионов Cr2+ выступают в качестве акцепторов для образования пяти ковалентных связей с ацетатными группами и молекулами воды. В образующейся частице все электроны спарены, т.е. она является диамагнитной (см. рис 1 (б)). При нагревании в вакууме до 120°С ацетат хрома теряет воду, превращаясь в коричневый порошок, в котором кластеры Cr2 (CH3COO) 4 связаны между собой дополнительным взаимодействием атомов хрома с атомами кислорода соседних ацетатных групп (см. рис 1 (в)). Образование связи Cr-Cr по методу молекулярных орбиталей (МО) представлено на рис.2. Для простоты рассмотрено взаимодействие двух фрагментов молекулы состава Cr (CH3COO) 2, каждый из которых имеет форму плоского квадрата, что видно из расщепления исходных d- орбиталей хрома. Из пяти d -орбиталей каждого фрагмента четыре идут на образование связи Cr-Cr, а одна - на образование σ-связи с молекулой воды. Из восьми d -орбиталей, предоставленных в общее пользование двумя атомами хрома, образуются восемь молекулярных орбиталей (МО) - две из них σ-типа, четыре - π-типа и две δ-типа. Электронами заполнены четыре связывающие МО, что обусловливает образование четырехкратной связи Cr-Cr.
|
|
|
Благодаря кластерному строению ацетат хрома (II) гораздо более устойчив к окислению, чем простые соли хрома (II). В качестве исходного вещества его используют для синтеза других соединений CrII.
§3. Хром (III) (d3).
Общая характеристика комплексных соединений хрома (III)
Степень окисления +3 наиболее характерна для хрома. Для этого состояния характерно большое число кинетически устойчивых комплексов. Именно из-за такой кинетической инертности удалось выделить в твердом состоянии большое число комплексных соединений хрома, которые в растворе остаются неизменными в течение длительного времени.
Наличие трех неспаренных электронов обусловливает парамагнетизм соединений Cr (III), большинство из которых интенсивно окрашены. [6]
В литературе описано множество комплексов трехвалентного хрома. Во всех без исключения комплексах CrIII имеет координационное число (КЧ) шесть.
|
|
|
Ярко выраженная способность трехвалентного хрома к образованию комплексных соединений особенно отчетливо проявляется в его различных комплексных продуктов присоединения аммиака.
В соответствии со своим КЧ 6 ион хрома (III) может координационно связать шесть молекул аммиака. При этом образуется комплексный ион [Cr (NH3) 6] 3+, заряд которого совпадает с зарядом хрома, фигурирующего в качестве центрального атома, поскольку молекулы аммиака не заряжены.
Вследствие прочного связывания молекул аммиака при растворении в воде соединений, содержащих комплекс [Cr (NH3) 6] 3+, не происходит моментального распада комплекса - он существует в растворе как ион и лишь постепенно происходит замещение аммиака молекулами воды.
[Cr (NH3) 6] 3+ 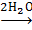 [Cr (H2O) 2 (NH3) 4] 3+
[Cr (H2O) 2 (NH3) 4] 3+ 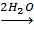 [Cr (H2O) 4 (NH3) 2] 3+
[Cr (H2O) 4 (NH3) 2] 3+  [Cr (H2O) 6] 3+
[Cr (H2O) 6] 3+
Исследования поведения гексаакваиона хрома (III) в растворах соляной кислоты во времени, позволили установить, что равновесие в системе Cr3+-H2O-Cl - [7] устанавливается примерно 3,5 месяца.
Комплексообразование в этих растворах протекает последовательно по ступеням во времени:
[Cr (H2O) 6] 3+ 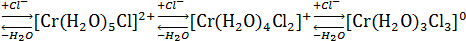
Спектры поглощения растворов показывают, что даже в самом концентрированном относительно соляной кислоты растворе (12 н) комплексообразование заканчивается на третьей ступени.
Таким образом, реакция внедрения ионов хлора в координационную сферу комплекса протекает крайне медленно, инертными являются не только гексааквокомплекс, но и смешанные аквахлориды хрома (III) по отношению к реакции обмена молекул воды на хлорид-ионы, происходящего в процессе образования комплексов; инертность смешанных комплексов уменьшается с увеличением числа ионов хлора в координационной сфере комплекса.
Процессы акватации транс- и цис- дихлородиэтилендиамминхромихлорида:
[Cr (en) 2Cl2] +  [Cr (en) 2Cl (H2O)] 2+
[Cr (en) 2Cl (H2O)] 2+  ] 3++Cl-
] 3++Cl-
Гидроксил может образоваться из молекулы воды, содержащейся во внутренней координационной сфере, в результате отщепления протона. Вероятность образования гидроксила во внутренней координационной сфере растет при повышении рН и уменьшается при понижении рН. Поэтому прибавление кислоты понижает вероятность образования гидроксила во внутренней координационной сфере и, следовательно замедляет процессы акватации именно тех ацидокомплексов, во внутренней координационной сфере которых содержится молекула воды. Если же во внутренней координационной сфере нет молекулы воды, то такого рода влияние величины рН исключается.
Достаточно широко исследовано влияние ионов Cr2+ на процессы акватации ацидохроми-комплексов. Оказалось, что ионы Cr2+ катализируют процессы акватации изученных ацидохроми-комплексов.
Например, каталитический процесс акватации транс-дихлородиаминхроми-хлорида протекает следующим образом. Вероятно, катализатор образует промежуточный комплекс, в котором связь между атомами Cr2+ и Cr3+ осуществляется через ион хлора:
Транс - [CrIII (en) 2Cl2] + + [CrII (H2O) 6] 2+  [Cl (en) 2CrIII, II - Cl - CrII, III (H2O) 5] 3+.
[Cl (en) 2CrIII, II - Cl - CrII, III (H2O) 5] 3+.
После передачи электрона может произойти распад комплекса. Наиболее вероятен распад по связи CrII - Cl:
[Cl (en) 2CrII-Cl-CrIII (H2O) 5] 3+ → [Cl (en) 2CrII (H2O)] + + [ClCrIII (H2O) 5] 2+,
освободившееся координационное место у CrII заняла молекула воды.
Замена во внутренней сфере одних лигандов другими часто сопровождается отчетливым изменением окраски комплекса.
Ион [Cr (H2O) 6] 3+ поглощает свет в красной, голубой частях видимого спектра, а также в ближайшей ультрафиолетовой области, поэтому имеет фиолетовую окраску, вызванную наложением двух дополнительных цветов.
Известно много комплексных анионов состава [CrX6] 3-, где Х - монодентатный лиганд типа F-, Cl-, NCS-, CN-, или часть полидентатного аниона типа оксалата (C2O42-). Существует, разумеется, множество смешанных ацидоамино - и и ацидоакво - комплексов.
Проведем некоторую их классификацию[8]:
1) [Cr (NH3) 6] 3+, [Cr (NH3) 5 (H2O)] 3+, [Cr (NH3) 4 (H2O) 2] 3+, [Cr (NH3) 3 (H2O) 3] 3+, [Cr (NH3) 2 (H2O) 4] 3+, [Cr (H2O) 6] 3+
2) [Cr (NH3) 5Cl] 2+, [Cr (NH3) 4 (H2O) Cl] 2+, [Cr (NH3) 3 (H2O) 2Cl] 2+, [Cr (NH3) 2 (H2O) 3Cl] 2+, [Cr (H2O) 5Cl] 2+
3) [Cr (NH3) 4 (SCN) 2] +, [Cr (NH3) 3 (H2O) (SCN) 2] +, [Cr (NH3) 2 (H2O) 2 (SCN) 2] +, [Cr (H2O) 4 (SCN) 2] +
4) [Cr (NH3) 3 (OH) 3], [Cr (NH3) 2 (H2O) (OH) 3], [Cr (H2O) 3 (OH) 3]
5) [Cr (NH3) 2 (SCN) 4] -, [Cr (H2O) 2 (SCN) 4] -
6) [Cr (H2O) (SCN) 5] 2-
7) [CrCl6] 3-
Важно заметить, что во всех рядах отсутствуют моноамминные соединения, и отсутствуют только они, указывает на существование какой-то закономерности, проявляющейся в неспособности к существованию моноамминных соединений.
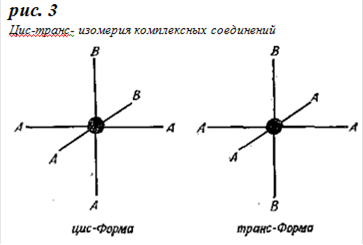
Большой интерес представляют соединения типа: [CrAm4R2] + [CrAm2R4] -. Из соединений первого типа известны главным образом соединения этилендиамина. Они интересны ввиду наблюдающегося у них явления изомерии (стереоизомерии) [9]. При октаэдрическом расположении комплексно связанных групп А и В вокруг центрального атома комплекс с общей формулой [ZA4B2] может существовать в двух формах (см. рис.3)
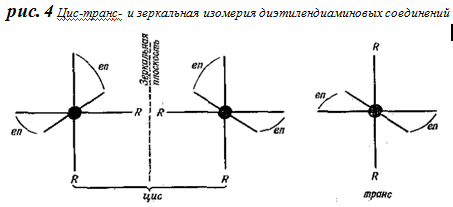
В случае этилендиаминных соединений различие заключается еще и в том, что в противоположность транс-соединению цис-соединение представляет собой смесь двух оптически активных форм, поскольку, как видно из рис.4, в этом случае могут существовать две цис-формы, относящиеся друг к другу, как предмет к его зеркальному отражению.
Переходя к рассмотрению второго типа соединений, нужно подчеркнуть, что поскольку в состав комплекса входят четыре отрицательных эквивалента, он представляет собой анион и образует соли с металлами. Хорошо известно соединение, принадлежащее к данному классу, так называемая соль Рейнеке NH4 [Cr (NCS) 4 (NH3) 2] ×H2O, анион которой часто применяют для осаждения больших катионов, как органических, так и неорганических, соль Рейнеке удобно использовать для количественного определения меди, так как можно легко провести осаждение последней в форме Cu [Cr (NCS) 4 (NH3) 2], не удаляя из раствора другие металлы (кроме Ag, Hg, Tl). Реакция с солью Рейнеке может служить также и как очень чувствительная качественная проба на медь.
Соль Рейнеке
Общие сведения
Из тетрацидодиаминовых комплексов хрома (III) наиболее давно известным является соль эмпирического состава Cr (NCS) 3×NH4SCN×2NH3×2H2O. Координационная формула этого соединения представляется в виде NH4 [Cr (NCS) 4 (NH3) 2] ×H2O. Соль эта, следовательно, может быть рационально названа тетрароданодиамминхромиат аммония.
Однако как эту соль, так и другие, образующиеся из нее путем замены аммония на другие катионы, часто называют просто солями Рейнеке. Свободную кислоту Н [Cr (NCS) 4 (NH3) 2], которая может быть получена при взаимодействии Ba [Cr (NCS) 4 (NH3) 2] 2 с разбавленной серной кислотой, также часто называют кислотой Рейнеке. В литературе даже встречается иногда и термин "рейнекат" ("рейнекеат"), применяемый для обозначения солей Рейнеке.
Пространственное строение данной соли было выяснено с помощью рентгеноструктурного анализа.
Оказалось, что молекулы аммиака расположены в транс-положении друг к другу[10]. В этой же работе было также показано, что в анионе соли Рейнеке роданогруппа связана с хромом через атом азота. [11]
Получены также производные иона тетрароданодиамминхрома (III), содержащие вместо одной роданогруппы остаток ОН-, т.е. соли типа М [Cr (NH3) 2 (NCS) 3OH]. Также получены диоксалатодиамминхромиаты типа Me [CrPy2 (NCS) 4] и другие аналогичные соли.
Применение
Как уже отмечалось, соль Рейнеке довольно широко применяется в аналитической химии, для определения ионов меди, серебра, ртути, кадмия и висмута образуя пучки тонких игл. На серебро, как правило, используют соль Рейнеке в сочетании с тиомочевинной, образуется осадок состава: [Ag (SCN2H4) 2] × [Cr (NH3) 2 (SCN) 4], предел обнаружения 0,4 мкг, предел разбавления 1: 2500 (г/г).
Также она применяется и в органическом анализе, например для определения никотина[12], атропина[13], морфина[14]:
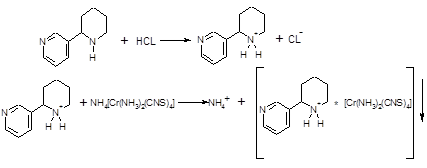
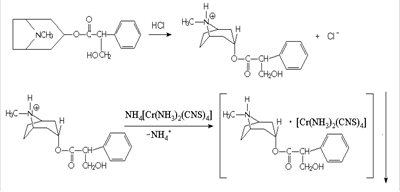
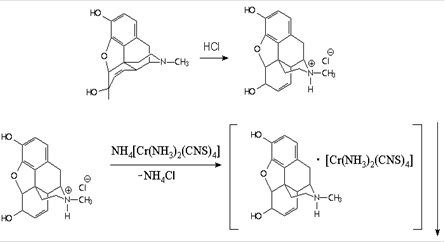
Сведения о соединениях содержащих анион [Cr (NH3) 2 (NCS) 4] - достаточно ограничены, не смотря на то, что тетраизотиоцианатодиамминхроматные комплексы могут обладать рядом специфических свойств.
 2020-01-14
2020-01-14 6181
6181







