Тема: Предельные углеводороды.
Химические свойства алканов (метана, этана): горение, замещение, разложение, дегидрирование.
Рассмотрим основные свойства, характерные для алканов. Все связи в алканах малополярные, поэтому для них характерны радикальные реакции. Отсутствие пи-связей делает невозможными реакции присоединения.
Для алканов характерны реакции замещения, отщепления, горения.
1. Реакции замещения
А) с галогенами (с хлором Cl2 –на свету, Br2- при нагревании) реакция подчиняется правилу Марковника (Правила Марковникова) — в первую очередь галоген замещает водород у наименее гидрированного атома углерода. Реакция проходит поэтапно — за один этап замещается не более одного атома водорода.
Труднее всего реагирует иод, и притом реакция не идет до конца, так как, например, при взаимодействии метана с йодом образуется йодистый водород, реагирующий с йодистым метилом с образованием метана и йода(обратимая реакция):
CH4 + Cl2 → CH3Cl + HCl (хлорметан)
CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан)
|
|
|
CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан)
Б) Нитрование (Реакция Коновалова)
Алканы реагируют с 10% раствором азотной кислоты или оксидом азота N2O4 в газовой фазе при температуре 140° и небольшом давлении с образованием нитропроизводных. Реакция так же подчиняется правилу Марковникова. Один из атомов водорода заменяется на остаток NO2 (нитрогруппа) и выделяется вода

Реакции отщепления
А) дегидрирование –отщепление водорода. Условия реакции катализатор –платина и температура.
CH3- CH3→ CH2= CH2 + Н2
Б) крекинг процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью. При температуре 450–700 oС алканы распадаются за счет разрыва связей С–С (более прочные связи С–Нпри такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов
C6H14  C2H6 + C4H8
C2H6 + C4H8
В) полное термическое разложение
СН4  C + 2H2
C + 2H2 
Реакции окисления
А) реакция горения При поджигании (t = 600oС) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды.
СnН2n+2 + O2 ––>CO2 + H2O + Q
СН4 + 2O2 ––>CO2 + 2H2O + Q
Б) Каталитическое окисление - при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–Спримерно в середине молекулы и С–Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов.

Например, при неполном окислении бутана (разрыв связи С2–С3) получают уксусную кислоту
4. Реакции изомеризациих арактерны не для всех алканов. Обращается внимание на возможность превращения одних изомеров в другие, наличие катализаторов.
|
|
|
С4Н10  C4H10
C4H10
5.. Алканы с основной цепью в 6 и более атомов углерода также вступают в реакцию дегидроциклизации, но всегда образуют 6-членный цикл (циклогексан и его производные). В условиях реакции этот цикл подвергается дальнейшему дегидрированию и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода (арена).

Получение алканов.
Алканы выделяют из природных источников (природный и попутный газ, нефть, каменный уголь).
Газообразные алканы получают из природного и попутных нефтяных газов, а твердые алканы — из нефти. Природной смесью твердых высокомолекулярных алканов является горный воск — природный битум.
Метан широко распространен в природе. Он является главной составной частью многих горючих газов как природных (80-97%), так и искусственных, выделяющихся при сухой перегонке дерева, торфа, каменного угля, а также при крекинге нефти. Природные газы, особенно попутные газы нефтяных месторождений, помимо метана содержат этан, пропан, бутан и пентан.
Метан выделяется со дня болот и из каменноугольных пластов в рудниках, где он образуется при медленном разложении растительных остатков без доступа воздуха. Поэтому метан часто называют болотным или рудничным газом.
В промышленности
1. Получение алканов из природных источников (нефть, природный газ)

2. Синтезом на основе водяного газа из оксида углерода (II) и водорода можно получить метан:
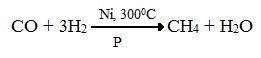
3. Синтезом из водяного газа (СО+Н2) получают смесь алканов:

В лаборатории
1. Метан можно получить синтезом из простых веществ при нагревании, повышенном давлении в присутствии катализатора (Ni):

2. Гидролиз карбида алюминия (получение метана)

3. Взаимодействие карбида алюминия с сильными кислотами
4. Сплавление солей уксусной кислоты со щелочами (реакция Дюма) 
5. Каталитическое гидрирование (+Н2) непредельных углеводородов

6. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Происходит димеризация углеродной цепи исходного галогеналкана, образуется алкан с четным числом атомов углерода в цепи:

Если в реакции участвуют разные галогеналканы, то образуется смесь алканов:

7. Электролиз растворов солей карбоновых кислот (реакция Кольбе)

Применение алканов на основе свойств.
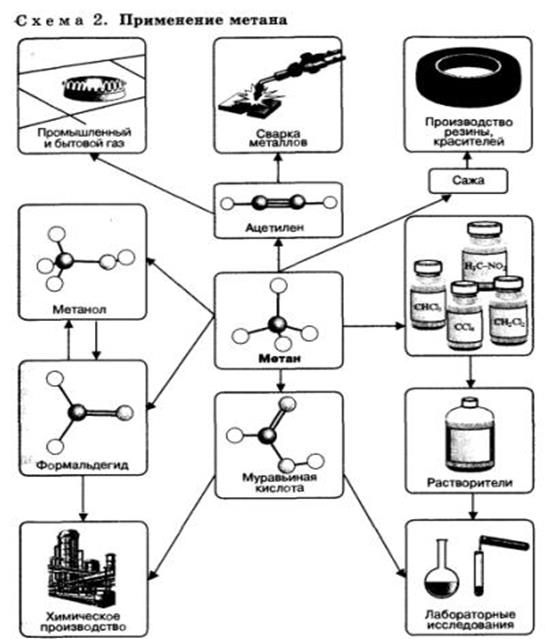
Предельные углеводороды, в особенности метан, находят очень широкое применение в промышленности (схема 2). Они являются простым и достаточно дешевым топливом, сырьем для получения большого количества важнейших соединений.
Соединения, полученные из метана, самого дешевого углеводородного сырья, применяют для получения множества других веществ и материалов. Метан используют как источник водорода в синтезе аммиака, а также для получения синтез-газа (смесь СО и Н2), применяемого для промышленного синтеза углеводородов, спиртов, альдегидов и других органических соединений.
 2020-05-11
2020-05-11 362
362






