Глоссарий:
Протон – стабильная элементарная частица, ядро атома водорода.
Нейтрон – элементарная частица, не имеющая заряда.
Протонно-нейтронная модель ядра Гейзенберга-Иваненко: ядро любого атома состоит из положительно-заряжённых протонов и электронейтральных нейтронов.
Массовое число – сумма числа протонов Z и числа нейтронов N в ядре.
Нуклоны – протоны и нейтроны в составе атомного ядра.
Изотопы – разновидность данного химического элемента, различающиеся по массе атомных ядер, т. е. числом нейтронов.
Ядерные силы – это силы притяжения между нуклонами в ядре.
Дефект масс – разность масс нуклонов, составляющих ядро, и массы ядра
В 1919 году Резерфорд открыл протон при бомбардировке ядра атома азота α-частицами.
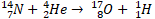
Это была первая ядерная реакция, проведённая человеком. Превращение одних атомных ядер в другие при взаимодействии их с элементарными частицами или друг с другом называют ядерной реакцией.
Состав ядра: Ядро состоит из протонов и нейтронов.
|
|
|
Протон – стабильная элементарная частица, ядро атома водорода. Свойства протона:
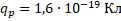
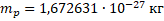
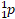 или
или 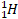 – символ протона.
– символ протона.
Нейтрон был открыт в 1932 г. Д. Чедвиком при облучении бериллия α-частицами. Нейтрон - элементарная частица, не имеющая заряда. Свободный нейтрон, который находится вне атомного ядра, живёт 15 минут. Потом он превращается в протон, испуская электрон и нейтрино – безмассовую нейтральную частицу.
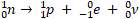
Свойства нейтрона:
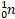 – символ нейтрона
– символ нейтрона
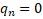
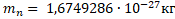
В 1932 году советский физик Д. Д. Иваненко и немецкий физик В. Гейзенберг выдвинули гипотезу о протонно-нейтронном строении ядра. Справедливость этой гипотезы была доказана экспериментально. Согласно этой модели ядра состоят из протонов и нейтронов. Так как атом не имеет заряда, т.е. электрически нейтрален, число протонов в ядре равно числу электронов в атомной оболочке. Значит, число протонов в ядре равно порядковому номеру химического элемента Z в периодической таблице Менделеева.
Сумму числа протонов Z и числа нейтронов N в ядре называют массовым числом и обозначают буквой А или М:
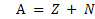 М = Z + N, Z- порядковый номер элемента в таблице Менделеева или число протонов. N – число нейтронов, N = М - Z
М = Z + N, Z- порядковый номер элемента в таблице Менделеева или число протонов. N – число нейтронов, N = М - Z
Ядерные частицы – протоны и нейтроны – называют нуклонами.
Радиус ядра находится по формуле:
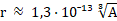
Изотопы – разновидность данного химического элемента, различающиеся по массе атомных ядер, т. е. числом нейтронов.
Устойчивость ядер зависит от отношения числа нейтронов к числу протонов.
Ядерные силы – это силы притяжения между нуклонами в ядре. Это самые мощные силы в природе, их ещё называют «богатырь с короткими рукавами». Они относятся к сильным взаимодействиям.
|
|
|
Свойства ядерных сил:
1) это силы притяжения;
2) примерно в 100 раз больше кулоновских сил;
3) зарядовая независимость;
4) короткодействующие, проявляются на расстояниях порядка 10-12 -10-13 см;
5) взаимодействуют с конечным числом нуклонов.
Масса любого атомного ядра всегда меньше, чем масса составляющих его частиц:
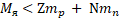
Дефект масс - разность масс нуклонов, составляющих ядро, и массы ядра:
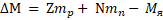
Энергия связи – это минимальная энергия, необходимая для полного расщепления ядра на отдельные частицы:
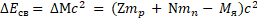
Удельная энергия связи – это полная энергия связи ядра, деленная на число нуклонов:
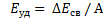
Молодой физик Эрнест Резерфорд около ста лет назад разобрался в явлении ионизации газов только что открытыми радиоактивными веществами. В своих опытах в роли электроскопа, быстро разряжавшегося при ионизации воздуха, он использовал... шелковую кисточку. Резерфорд приводил её в рабочее состояние, поглаживая ее основания «теплым сухим кисетом» для табака. Вот это уровень экспериментальной техники всего лишь вековой давности!
Алхимикам не удалось преобразовать ядра атомов, т.е. из одного химического элемента получить другой, потому что энергия связи в ядрах (в расчете на одну частицу), примерно в миллион раз (!) превышает химическую энергию связи атомов между собой.
В 1915 году американский физик Уильям Харкино первым сделал предположение, что устойчивость атомных ядер обеспечивается энергией связи. Он также первым ввёл понятие «дефект масс».
Английский же ученый Фрэнсис Астон сконструировал масс-спектрограф. На нём он сделал точнейшие измерения. И в 1927 году построил кривую, которая описывает энергию связи. Более устойчивы к распаду и имеют большие значения энергии связи ядра атомов, которые содержат определенные, так называемые магические, числа протонов и нейтронов. В подмосковной Дубне был получен 114-й химический элемент при поисках таких стабильных ядер.
- Внимательно прочитав текст, составьте конспект по плану:
1. Записать состав ядра с характеристикой протонов и нейтронов.
2. Что такое массовое число (формула).
3. Что такое изотопы.
4. Что такое ядерные силы и их свойства.
5. Что такое дефект масс, с формулой.
6. Что такое энергия связи ядра, с формулой.
- выполнить примеры:
массовое число М, число протонов Z, число нейтронов N.
Формулы:
М = Z + N, Z = М – N, N = М - Z
1. Заполните пропуски в таблице:
| Химический элемент | Число протонов | Число нейтронов | Массовое число |
| Медь | 35 | 64 | |
| Бор | 5 | 11 | |
| Цинк | 30 | 35 |
2. Соедините попарно элементы двух множеств:
Заряд частицы:
1) заряд протона;
2) заряд нейтрона;
3) заряд электрона.
Величина заряда:
1) 0;
2) 1,6 ∙ 10-19 Кл;
3) 2 ∙ 10-16 Кл;
4) - 1,6 ∙ 10-19 Кл.
 2020-08-05
2020-08-05 106
106






