Предмет: МДК 04.01Обработка и учет результатов анализа
Из конспектов 2-курса по МДК02.01 и ОП02 вы должны повторить теоретический материал и формулы для решения задач.
1. N= 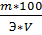 (N, н) нормальность, m – масса вещества в (г), V –объем раствора (см3), Э – эквивалентная масса (г/моль), Мr- молярная масса (г/моль)
(N, н) нормальность, m – масса вещества в (г), V –объем раствора (см3), Э – эквивалентная масса (г/моль), Мr- молярная масса (г/моль)
2.М= 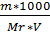 (М)молярная концентрация;
(М)молярная концентрация;
Вопросы для повторения (письменно)
1. Что называется концентрацией раствора? 2. Как выражается концентрация (единицы измерения ) 3. Что означает показатель плотности, запишите формулу.? Дать определение молярной и нормальной концентрации, ед. измерения.4.Что наз. Эквивалентом? 5. Рассчитать эквиваленты веществ: сульфата кальция, хлорида алюминия, азотной кислоты, ортофосфорной кислоты.
2.Задача: Раствор, содержащий 4,90г серной кислоты в 100см3, имеет эквивалентную массу (нормальную) Э=49,0 и молярную Мr=98,0г/моль Рассчитать нормальную и молярную концентрации?
Предмет: МДК 03.01 Экологический контроль.
Лабораторное занятие №1 (№2 по уч. плану)
Работу выполняйте в предложенной методичке. Правильно делайте выводы. Отвечайте на вопросы.

http://www.studfiles.ru/preview/2905675/ - Файловый архив для студентов. Все предметы. Природопользование – лекции.
Теоретические основы
Высокие концентрации веществ, содержащих железо, придают воде плохой вкус, вызывают нежелательные отложения в трубах. Соединения, содержащие серу, придают воде неприятный запах. Вещества, содержащие ртуть, свинец, кадмий и мышьяк, могут растворяться в воде, и в малых концентрациях опасны для здоровья людей.
Солнечный свет может вызвать образование потенциально вредных веществ при освещении хлорированной воды, если она содержит некоторые примеси.
Модельные загрязнения (искусственно приготовленные образцы) воды моделируют сточные воды с их типичными загрязнителями.
Ход работы
Вводный инструктаж
· актуализация опорных знаний
· объяснение практической работы
· инструктаж по технике безопасности
·
Задание: произвести анализ модельного раствора методом сравнения с окраской контрольной шкалы цветных образцов на этикетке тест-системы. Определить ориентировочную величину концентрации загрязнителя в растворе.
Алгоритм выполнения лабораторного задания
1. Налить в пробирку около 5 мл воды
2. Внести в пробирку несколько кристалликов какой-либо соли – загрязнителя.
1. Закрыть пробирку пробкой, после чего содержимое пробирки перемешать, покачивая и потряхивая ее до растворения соли.
2. Поместите пробирку в штатив. Обратите внимание на внешний вид – цвет и мутность раствора, сравнивая его по внешнему виду с растворами в других пробирках (с другими модельными растворами).
3. Отрежьте ножницами кусочек индикаторной полоски тест-системы размером 5х5 мм.
Внимание! Изучите правила тестирования на обложке тест-системы.
4. Зажмите кусочек полоски пинцетом и опустите его в раствор
5. Выдержите кусочек полоски в растворе в течение времени, указанного на этикетке тест-системы
6. Сравните окраску полоски с окраской контрольной шкалы цветных образцов на этикетке тест-системы, выбрав образец, ближайший по интенсивности и характеру окраски тестируемого кусочка. Определите ориентировочную величину концентрации загрязнителя в растворе.
7. Занесите полученные экспериментальные данные в таблиц
Таблица
| Вид загрязнителя | Концентрация загрязнителя в сточной воде мг/л (ориентировочно) | Количество чистой воды для разбавления Ответить на вопрос? | Значение ПДК, мг/мл | |
| 1. | нитраты | 45 мг/л | Требуется?(да, нет) | 45мг/л |
| 2. | Общее железо | 100мг/л | Требуется? (да.нет, какое количество воды?) | 0,3 мг/л |
| 3. | Соляная кислота | 2-2,5 мг/л | Требуется? (да, нет, сколько?) | 6,5 мг/л |
.Справочные данные по ПДК см. в таблице «Показатели качества воды»
8. Рассчитайте количество чистой воды, необходимое для разбавления загрязненной сточной воды до допустимых норм, полученные результаты внесите в таблицу.
Вывод:
…………………………………………………………………………………………………………………………………………………………………………………………………………
Контрольные вопросы
- Для чего необходимо контролировать сточные воды на загрязнители?
- Какие загрязнители вы знаете?
- Как солнечный свет влияет на загрязненную воду?
 2020-09-27
2020-09-27 110
110







