Пример 1. Распределить электроны в атоме азота N по энергетическим уровням согласно правилу Хунда (Гунда).
Решение приведено на рис. 4.
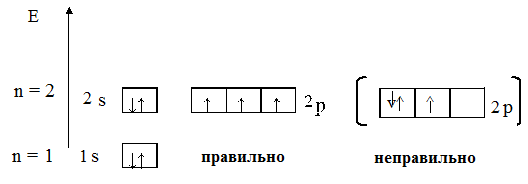
Рис. 4
Правило Хунда гласит: заселение орбиталей, относящихся к одному и тому же энергетическому подуровню, начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заселение орбиталей парами электронов с противоположными спинами. В результате суммарный спин (и сумма спиновых квантовых чисел) всех электронов в атоме будет максимальным.
Пример 2. Показать электронную конфигурацию атома  .
.
Решение. Энергетическая диаграмма распределения электронов в атоме Са представлена на рис. 5.

Рис. 5
Согласно правилу Клечковского сначала заполняется орбиталь 4 s, а затем 3 d.
Распределение соответствует электронной конфигурации – 1 s 22 s 22 p 63 s 23 p 6 4 s 2.
Пример 3. Определить геометрическое строение (конфигурацию) молекулы метана СН4.
|
|
|
Решение. Запишем валентные электронные конфигурации атомов водорода и углерода: H − 1 s 1; C − …. 2 s 22 p 2.
Атом углерода образует четыре связи с атомами водорода. Следовательно, он должен иметь четыре неспаренных электрона. Для объяснения этого факта следует предположить, что в результате поглощения энергии этим атомом углерода один из 2 s -электронов переходит на свободную 2 р -орбиталь и атом углерода переходит в так называемое «возбужденное» состояние: C* −…. 2 s 12 p 3, s - и р -электроны у атома углерода энергетически не равноценны, а опытные данные говорят, что все четыре связи в молекуле метана энергетически равноценны, т.е. можно предположить гибридизацию АО.
Гибридизация, в которой участвуют атомные орбитали одного
s - и трех p -электронов, называется sр 3- гибридизацией (рис. 6).


Рис. 6
 Рис. 7. sр 3-гибридиза-
ция в молекуле СН4
Рис. 7. sр 3-гибридиза-
ция в молекуле СН4
|
В молекуле метана угол между осями четырех гибридных орбиталей составляет 109°28'. Молекула метана имеет форму тетраэдра (рис. 7).
Пример 4. На основе метода валентных связей (МВС) предположить пространственное строение молекулы СО2 и определить, является ли молекула диполем. Значения электроотрицательностей c элементов представлены в табл. 2.
Т а б л и ц а 2
 2020-10-09
2020-10-09 228
228








