Лекция №15
Зависимость адсорбции от температуры и вида газа
В уравнении Ленгмюра коэффициент адсорбции в=к1/к2. (к1 – константа адсорбции; к2 константа десорбции). Так вот, величина к1 мало зависит от температуры. Константа к2 зависит от температуры. Для того, чтобы адсорбированная молекула могла покинуть поверхность адсорбента, она должна обладать энергией, большей теплоты адсорбции (энергии адсорбционных сил). Повышение температуры увеличивает кинетическую энергию молекул и облегчает десорбцию. Зависимость к2 от температуры подчиняется закону Больцмана:
к2=к0е-Q/RT где Q – теплота адсорбции. Таким образом, с увеличением температуры количество газа, адсорбированного на поверхности уменьшается. Что касается зависимости адсорбции от вида газа, то при малых давлениях газа существенных различий в адсорбции нет, а при больших давлениях газа над поверхностью адсорбента сильнее адсорбируются те газы, которые легче конденсируются в жидкость, и которые, следовательно, обладают высокой температурой кипения.
|
|
|
Функциональными группами органических анионитов являются: аминогруппа (-NH2); и миногруппа (=NH) и группа четырех замещенного аммония (-NR3OH). Группы (-NH2) и (=NH) являются производными аммиака NH3 (образовались путем замены одного или двух атомов водорода органическими радикалами, например С2Н5 – NH2); ((СН3)2=NH) и подробно NH3 обладают способностью образовывать комплексы с ионами Н+:
-NH2+H+®-NH3+
=NH+H+®=NH2+.
Таким образом, в анионитах, содержащих группу -NH2 и =NH, образование функциональной группы и потенциалобразующего слоя происходит в результате адсорбции ионов Н+ из раствора. В растворе при этом создается диффузный слой (ионная атмосфера). Аниониты, содержащие эти группы являются слабоосновными.
Группа (-NR3OH) является производной гидроокиси аммония NH4OH, в которой четыре атома Н замещены органическими радикалами.
(записывается такая функциональная группа в виде (-NR3OH), т.к. (-) показывает связь функциональной группы с органическим радикалом).
Эта группа проявляет сильноосновные свойства и, соответственно, ионит имеющий функциональную группу (-NR3OH) является сильноосновным.
Потенциалообразующий слой и ионная атмосфера в анионите с такой функциональной группой создаются при диссоциации иона гидроксила ОН-.
Таким образом, катиониты подразделяются на сильнокислотные и слабокислотные, а аниониты – на сильноосновные и слабоосновные по способности функциональных групп ионитов к диссоциации и, следовательно, по способности к адсорбции ионов из раствора. Сильнокислотный катионит и сильноосновной анионит диссоциирует при любых значениях рН раствора и, следовательно, способны к обмену (адсорбции) из раствора всех ионов (катионов и анионов – соответственно). Слабокислотный катионит плохо диссоциирует в кислой среде и плохо адсорбирует ионы из раствора (в кислой среде). Слабоосновной анионит – создает слабое электрическое поле в щелочной среде и практически способен к адсорбции лишь анионов сильных кислот.
|
|
|
Такое деление ионитов на сильные и слабые можно сравнить с делением кислот и оснований на сильные и слабые.
Рассмотрим кислоту СН3СООН (уксусная кислота). В воде кислота диссоциирует на ионы по уравнению
СН3СООН«СН3СОО-+Н+
В состоянии равновесия 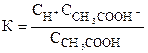
Логарифмируя, получим:
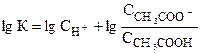 ,
,
т.к. рН=-lgСн+, рН=-lg К, то
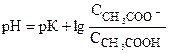 или
или
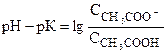 . (1)
. (1)
Если в состоянии равновесия большая часть исходной кислоты диссоциирована на ионы, то ССН3СОО->ССН3СООН и 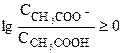 , т.е. рН-рК³0.
, т.е. рН-рК³0.
Таким образом, условием хорошей диссоциации кислоты является рН-рК³0.
Т.к. для СН3СООН рК»5, то эта кислота достаточно полно диссоциировать будет при рН>5. При рН<5 кислота диссоциировать будет плохо, в растворе будет мало ионов Н+ и СН3СОО-.
Аналогично и для ионитов.
В катионите, содержащем функциональную группу (-СООН), диссоциация этой группы (и следовательно и способность катионита к адсорбции ионов из раствора) будет высокий, если рН-рК³0, где К – константа диссоциации ионита (гр. СООН в ионите). (Фун. гр. –СООН в катионите слабокислотная, если считать Кионита»10-5, то эта группа будет достаточно хорошо диссоциировать в воде лишь при рН³5. При обессоливании воды на ХВО и рН»2¸4, поэтому эта группа –СООН диссоциирует слабо и является поэтому слабокислотной.).
Для анионитов условие хорошей (достаточно полной) диссоциации выражается уравнением:
РОН-рК³0, т.е. 14-рН³0 или рН£14-рК.
 2014-02-04
2014-02-04 3536
3536
