Уравнение адсорбции Гиббса выведено при таких условиях:
а) замкнутая система, в которой объем Т=const; SVi=const
и имеет вид
ds=-SdmiГi. (1)
То есть, изменение поверхностного натяжения адсорбента определяется изменением химического потенциала и изменением числа молей при переходе адсорбата из объема к поверхности.
Если концентрации всех компонентов, кроме i-го, в поверхностном слое не изменяются, т.е. dm1=dm2=….=0, но dmi¹0, то при Т=const и V=const уравнение примет вид:
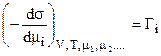 . (2)
. (2)
То есть величина адсорбции i-го компонента на поверхности жидкости (адсорбента), характеризуются величиной Гi, равна уменьшению поверхностного натяжения s на единичное изменение химического потенциала i-го компонента в процессе адсорбции.
Уравнение адсорбции Гиббса – (1) и (2) – позволяет определить адсорбцию на поверхности жидкости нерастворяющегося в ней газа и адсорбцию в поверхностном слое жидкости растворенного в ней вещества; т.е. относится к системам, состоящим из двух фаз (газ-жидкость) и двух компонентов (газ-жидкость, или растворитель и растворенное вещество).
В практических расчетах уравнение адсорбции Гиббса обычно используется в ином виде. Для того, чтобы получить такое уравнение, подставим выражение химического потенциала m=m0+RTlnp, справедливое для идеального газа или пара, в уравнение (2). Тогда получим:
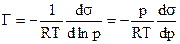 , (3)
, (3)
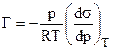 .
.
Величина Г представляет собой избыток адсорбата (газа) на поверхностном слое адсорбента (жидкости).
Для системы, представляющей собой раствор вещества в жидкости, при достаточном разбавлении раствора, химический потенциал растворенного вещества можно выразить в виде:
m=m0+Rt×lna или m»m0+Rt×lnС
где а и С – активность и концентрация растворенного вещества. Тогда, подставляя эти выражения в уравнение (2) получим
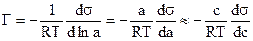 .
.
Уравнения (3) и (4) называются уравнениями изотермы адсорбции Гиббса, и позволяют графически представить изотерму адсорбции в виде зависимости Г=f(c).
Из уравнения (4) видно, что если с ростом концентрации растворенного вещества в растворе s - уменьшается, т.е., если ds/dc<0, то Г>0 и концентрация растворенного вещества в поверхностном слое больше, чем в объеме раствора, т.е. имеет место положительная адсорбция. В противном случае, т.е. если ds/dc>0, то Г<0, и концентрация растворенного вещества в поверхностном слое меньше, чем в объеме раствора (отрицательная адсорбция).
Для водных растворов, с которыми приходится иметь дело в энергетике, веществами с положительной адсорбцией обычно являются высокомолекулярные органические вещества, называемые ПАВ. Которые используются для удаления остатков масла и мазута в отработавших водах, путем создания пены, на которой адсорбируется капельки масла (флотация).
Молекулы таких ПАВ (и других веществ с положительной адсорбцией) в поверхностном слое ориентируются, создавая как бы “частокол”, в котором полярные группы, например СООН, обращены к воде, а неполярные – углеводородные радикалы – к воздуху.
Отрицательная адсорбция (Г<0) в практике имеет место при растворении в воде сильных электролитов (например, солей). В этом случае ионы, на которые диссоциирует сильные электролиты взаимодействуют с молекулами воды более интенсивно, чем молекулы воды друг с другом.
Поэтому ионы преимущественно распределяются в глубине раствора и в поверхностном слое их концентрация меньше, чем в объеме.
Изотермы адсорбции газов и паров (Изотермы адсорбции Генри и Ленгмюра)
Изотермой адсорбции называется кривая, выражающая зависимость адсорбции от концентрации или от давления. Г=f© или Г=f(p).
Изотерма адсорбции является одной из важнейших характеристик адсорбционных процессов.
Простейшим уравнением изотермы адсорбции для однородной поверхности, является уравнение Генри.
Но прежде чем перейти к выводу уравнения Генри, определим понятие адсорбционного равновесия.
Адсорбционным равновесием называется состояние подвижного термодинамического равновесия обратимого процесса адсорбции, т.е. равновесие характеризуется равенством скоростей адсорбции и десорбции Vад=Vдес.
Подобно тому, как изменяется концентрация реагирующих веществ в обратимых реакциях, в первый момент контакта адсорбента и адсорбата адсорбция вещества на поверхности идет очень быстро, а затем, по мере насыщения поверхности скорость адсорбции падает, а скорость десорбции (отрыва молекул адсорбата с поверхности) возрастает. В момент наступления равновесия Vад=Vдес.
1. Уравнение изотермы адсорбции Генри выведено для адсорбентов с однородной поверхностью, к которым можно отнести сажу, стекло, слюду, монокристаллы.
2. При этом предполагается, что при адсорбции газов на поверхности образуется мономолекулярный слой, толщина которого зависит от размера молекул газа и их ориентации у поверхности.
3. Концентрация вещества в адсорбционном слое принимается везде одинаковой. Адсорбционной поверхностью может быть и жидкость и твердое вещество. В состоянии адсорбционного равновесия для каждой температуры справедливо выражение:
N мол. (в газе)«n мол. (на адсорбенте)
Обозначим Са (моль/дм3) – концентрация вещества в адсорбционном слое; ¡а – коэффициент активности вещества в адсорбционном слое; С (моль/дм3) – концентрация вещества в газе; ¡ - коэффициент активности вещества в газе.
Тогда из закона распределения следует:
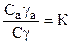 или
или
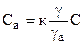 , (5)
, (5)
где К – константа равновесия, независящая от концентрации, или константа Генри (к=const при Т=const).
Это уравнение, представляющее собой зависимость Са=f(C)T есть уравнение изотермы адсорбции. При малой концентрации газа (вещества в газе) ¡»1 и gа»1, тогда
Са=кС (6)
Для идеальных газов из уравнения Менделеева-Клапейрона РV=nRT получим n/V=P/RT, т.к. n/V=C, то С=Р/RT, тогда. Подставляя (с) в уравнение (6), получим:
Са=Р/RT×К (7)
Са=К/RT×p (7¢)
Согласно уравнению 7¢ при малых давлениях газа, концентрация вещества со стороны газа в адсорбционном слое пропорциональна концентрации или давлению вещества в газовой фазе.
( т.е. здесь речь идет об адсорбции газа на твердой или жидкой поверхности; и под “веществом” понимается сорбат – газ).
Изотерма адсорбции Генри выглядит так:
При малых давлениях р (до р1) са=f(p) носит линейный характер. При увеличении р>р1 наблюдается отклонение от линейности (кривая 2), что определяется взаимодействием адсорбирующихся молекул вещества друг с другом. Т.е. скорость адсорбции уменьшается, а при дальнейшем росте р (или концентрации газа над поверхностью) наступает адсорбционное насыщение (кривая 2 стремится к пределу).
При этом при любом давлении газа р кривая адсорбции характеризует адсорбционное равновесие, т.е. равновесие между адсорбцией и десорбцией вещества на поверхности адсорбента.
Уравнение изотермы адсорбции Ленгмюра
Это уравнение также относится к случаю адсорбции газа (пара) на жидком или твердом адсорбенте. Это уравнение более точное, чем уравнение Генри. Выведено оно при таких предположениях:
1. Число мест на поверхности адсорбента ограничено, поэтому са увеличивается до Саmax, т.е. до насыщения.
2. Связь молекул вещества с адсорбентом достаточно прочна и адсорбированные молекулы не перемещаются по поверхности.
3. Адсорбция на одном месте не влияет на состояние другого.
4. Между адсорбированными молекулами отсутствует взаимодействие.
При равновесии скорость адсорбции равна скорости десорбции..
Скорость адсорбции пропорциональна концентрации (давлению) газа и количеству “свободных мест” поверхности адсорбента., т.е.
Vадс=к1С(1-q)
Где q - доля занятых мест,
(1-q) – доля свободных мест на поверхности:
к1 – константа скорости адсорбции.
Молекула десорбируется, если ее энергия достаточна для отрыва от поверхности. Число таких молекул пропорционально общему числу адсорбированных молекул: тогда vдес=к2q
Где к2 – постоянная величина (константа скорости десорбции).
В момент равновесия: к1С(1-q)=к2q откуда к1С1-к1Сq=к2q и q= к1С/(к2+к1С), делим числитель и знаменатель на к2 тогда
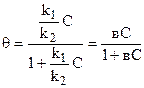 , (8)
, (8)
где к1/к2=в – постоянная для данного адсорбента (или коэффициент адсорбции).
Величина адсорбции вещества (газа) на поверхности Г выражается уравнением Г=Гmax q, т.е. пропорциональна максимально возможной адсорбции (Гmax) при всей занятой поверхности доля занятых ан поверхности мест q.
Т.е. при q=1 вся поверхность адсорбента покрыта мономолекулярным слоем адсорбированных молекул – Г=Гmax.
Подставляя q из уравнения (8), получим
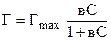 . (9)
. (9)
Это уравнение носит названия изотермы адсорбции Ленгмюра. Графически изотерму адсорбции Ленгмюра можно показать, т.е. зависимость Г=f(c) или Г=f(p). При малых значениях С, т.е. при малых давлениях газа над поверхностью вс<<1 и уравнение адсорбции Ленгмюра принимает вид Г=ГmaxвС, т.е. уравнение имеет вид Г=к¢С – а это не что иное, как уравнение Генри, т.е. при малых давлениях газа уравнение Ленгмюра переходит в уравнение Генри (участок I). При больших давлениях газа (большие значения С) вС>>1 и уравнение Ленгмюра принимает вид: Г=Гmax..
То есть адсорбция в насыщенном состоянии не изменяется с изменением р(или С) – этому соответствует участок III графика. Участок II – переход от линейной адсорбции к насыщению. Уравнение адсорбции Ленгмюра достаточно хорошо согласуется с опытными данными в области I и III, и не достаточно хорошо в области II. Это связано с тем. что при выводе сделан ряд допущений, тогда как на самом деле:
а) поверхность адсорбента неоднородна;
б) между адсорбированными частицами имеет место взаимодействие;
с) в ряде случаев встречается не моно- а полимолекулярная адсорбция.
Учет неоднородности поверхности адсорбента (особенно в твердых фазах) позволили Фрейндлиху получить такую эмпирическую зависимость Г=КС1/n где К и n – постоянные величины. Учет взаимодействия молекул вещества, адсорбированных на поверхности провели Брунауэр, Эммит и Теллер. В результате они получили формулу
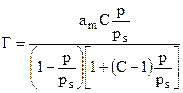 , (10)
, (10)
где Г – количество адсорбируемого вещества; аm – емкость одного монослоя; рs – давление насыщенного пара над поверхностью адсорбции; С – некоторая постоянная; Р - давление газа.
Это уравнение получило название уравнение адсорбции БЭТ по имени трех авторов.
 2014-02-04
2014-02-04 2867
2867








