В химии широко используется особая величина - количество вещества. Количество вещества определяется числом структурных единиц (атомов, молекул, ионов или др.) этого вещества и выражается в молях.
Моль - это количество вещества, содержащее столько структурных или формульных единиц, сколько атомов содержится в 12 г (0,012 кг) изотопа 12С.
Понятие «моль» распространяется на любые структурные единицы: атомы, молекулы, формульные единицы, катионы, анионы, электроны и другие.
Экспериментально установлено, что в 12 г изотопа 12С и, следовательно, в одном моле любого вещества, содержится 6,02∙1023 атомов. Это важная постоянная величина – постоянная Авогадро (NА); её размерность - моль–1.
При применении понятия «моль» надо чётко представлять себе, какие структурные единицы имеются в виду. Например, один моль атомарного водорода содержит 6,02·1023 атомов Н, один моль воды содержит 6,02·1023 молекул Н2О, один моль растворённого в воде хлорида натрия содержит 6,02·1023 ионов Na+ и 6,02·1023 ионов Cl–.
Количество вещества обозначается буквой n.
Молярная масса – это масса одного моля этого вещества. Молярная масса, выраженная в граммах, численно равна относительной молекулярной массе вещества, выраженной в атомных единицах массы. Так, молекула Н2О имеет относительную массу (Мr) 18 (а.е.м.), а 1 моль Н2О (т.е. 6,02×1023 молекул) имеет массу 18 г.
Масса m, молярная масса M и количество вещества n связаны между собойпростыми соотношениями:
1) n = 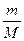 (моль)2) М =
(моль)2) М = 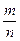 (г/моль ) 3) m = n∙M (г)
(г/моль ) 3) m = n∙M (г)
Пример 1. Какому количеству вещества соответствует 56 г азота и сколько молекул азота содержится в этом количестве?
Решение. Молярная масса азота (N2) равна 28 г/моль. Следовательно, 56 г азота соответствуют двум молям. Моль любого вещества содержит 6,02×1023 структурных единиц, следовательно, в двух молях азота содержится 12,04∙1023 молекул.
Пример 2. В результате реакции железа с серой получено 22 г сульфида железа (II). Какое количество сульфида железа соответствует этой массе?
Решение. Молярная масса сульфида железа (II) FeS равна 88 г/моль. Используя формулу 1, вычисляем количество FeS:
n 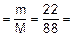 0,25 моль.
0,25 моль.
Пример 3. Каковы масса и количество воды, которые образовались при сгорании 8 г водорода?
Решение. Записываем уравнение реакции:
2Н2 + О2 = 2Н2О
В уравнении реакции коэффициенты перед формулами веществ (стехиометрические коэффициенты) показывают количества взаимодействующих и образющихся веществ. Из этого уравнения видно, что из двух моль водорода (2∙2 = 4 г) образуется 2 моля (2∙18 = 36 г) воды.
На основании этого составляем пропорцию и вычисляем массу воды:
из 4 г водорода получается 36 г воды
из 8 г получается Х г
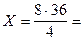 72 г.
72 г.
По формуле 1 находим количество воды:
n = 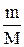 =
= 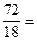 4 моль
4 моль
 2014-02-02
2014-02-02 3288
3288
