При растворении твердых веществ в воде может быть достигнуто состояние насыщения раствора, при котором для данной Т растворение вещества прекратится, при этом твердая фаза будет находиться в равновесии с растворенным веществом. Если вещество (соль MnAm) является электролитом, то в растворе установится равновесие
MnAm (тв.) Û n M+ + m A-
Константа диссоциации соли Кд = 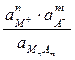 ;
; 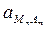 при данной Т является величиной постоянной.
при данной Т является величиной постоянной.
Кд × 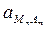 = ПР =
= ПР = 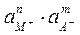
Т.о., в насыщенном растворе соли произведение активностей ее ионов есть величина постоянная, она называется произведением растворимости.
Если соль малорастворима и ее раствор разбавлен, то в выражении для ПР активности можно заменить концентрациями.
Из уравнения для ПР следует, что при добавлении к раствору малорастворимой соли хорошо растворимого соединения, имеющего общий ион с малорастворимой солью, растворимость соли будет уменьшаться. Кроме того, добавление посторонней соли к раствору увеличивает ионную силу этого раствора и уменьшает коэффициент активности той соли, которая находилась в растворе до введения посторонней добавки.
Величины ПР имеют большое практическое значение в химической технологии и в аналитической химии, т.к. они определяют условия, при которых должно происходить растворение солей или выделение их из растворов.
ПР наиболее точно можно измерить методом ЭДС; часто также пользуются определением растворимости по электропроводности насыщенных растворов, однако этот метод применим только к растворам чистой соли.
Лекция 45
 2014-02-13
2014-02-13 1087
1087








