ВОЛЬТАМПЕРОМЕТРИЯ
Применение вольтамперометрии в аналитических целях началось с разработки в 1922 г чешским ученым Я. Гейровским полярографического метода анализа. Он использовал ртутный капающий электрод, и область вольтамперометрии, связанная с использованием ртутного капающего электрода, стали называть полярографией. За открытие и развитие полярографического метода анализа в 1959 г. Я. Гейровскому была присуждена Нобелевская премия.
По разнообразию решаемых задач вольтамперометрические методы являются наиболее универсальными среди методов электрохимического анализа. Они позволяют одновременно получать качественную и количественную информацию о находящихся в растворе электроактивных, то есть способных вступать в химические реакции под действием электрического тока, веществах. Поскольку подбором соответствующих условий (растворителя, материала электродов, реагентов и т. п.) самые различные вещества могут быть переведены в электроактивное состояние, на сегодняшний день разработаны способы вольтамперометрического определения большинства элементов и весьма широкого круга неорганических и органических соединений в диапазоне концентраций от 10–3 до 10–11 моль/л.
Если к системе электродов, погруженных в раствор, приложить напряжение, то по цепи будет проходить электрический ток. При этом на электродах будут протекать электрохимические реакции окисления на аноде и восстановления на катоде. Ион может вступать в электрохимическую реакцию, только если достигается соответствующий окислительно-восстановительный потенциал, однако нередко электрохимическая реакция все равно не протекает. Причина этого кроется в сложном механизме электрохимического процесса, который включает:
1) перенос вещества к поверхности электрода;
2) передачу электрона (данная стадия может быть обратимой и необратимой, например реакция Fe3+ + ē = Fe2+ обратима, а реакция 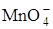 + 8H+ + 5ē = Mn2+ + 4H2O является многостадийной и не обратима);
+ 8H+ + 5ē = Mn2+ + 4H2O является многостадийной и не обратима);
3) отвод продуктов реакции, который в зависимости от природы иона и материала электрода может включать:
a) перенос вещества от поверхности обратно в раствор;
b) растворение вещества в материале электрода (в случае ртутного электрода);
c) электрокристаллизацию на поверхности электрода;
d) выделение газа;
e) химические реакции с образованием конечных продуктов.
Скорость процесса электропревращения определяется самой медленной его стадией. Если скорость какой-либо из стадий равна нулю, процесс вообще не протекает. В результате для протекания электродной реакции к электроду необходимо приложить дополнительный потенциал.
Поляризация может быть связана с различными стадиями электродного процесса, в соответствии с этим различают два вида поляризации – кинетическую и концентрационную.
Кинетическая поляризация (активационное перенапряжение) представляет собой сумму эффектов, связанных со стадиями 2, 3b, 3c, 3d и 3e. Этот вид поляризации зависит от материала электрода: для электродов из графита, платины, свинца, цинка и особенно ртути характерна наибольшая поляризация, а для хлоридсеребряного, каломельного и медного электродов поляризация не характерна. Обычно кинетическая поляризация уменьшается при уменьшении плотности тока и увеличении температуры. Она определяется рядом неконтролируемых параметров, поэтому ее невозможно точно рассчитать, а необходимо установить опытным путем.
Кинетическая поляризация существенно влияет на ток, протекающий через электрохимическую ячейку. На рис. 24 приведены зависимости тока от напряжения для двух электродных систем, помещенных в раствор инертного фонового электролита. Для первой системы, состоящей из медного рабочего электрода и неполяризованного электрода сравнения, ток непосредственно зависит от напряжения и описывается законом Ома. Такая электродная система не представляет интереса для химического анализа.
Во второй электродной системе в качестве рабочего используется поляризуемый ртутный электрод. На рисунке показано, что в области потенциалов от + 0,2 до – 2,0 В ток через электроды практически не протекает. За пределами этого диапазона ток резко увеличивается. Катодный ток в области отрицательных потенциалов обусловлен восстановлением ионов водорода. В положительной области потенциалов анодный ток вызван растворением ртути в результате электрохимической реакции.
|
|
|
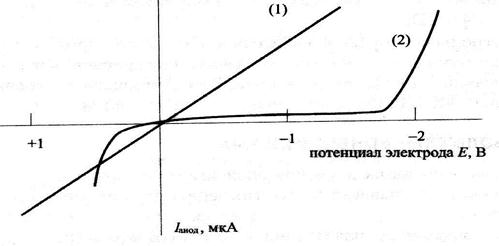
Рис. 24. Вольтамперные характеристики неполяризуемого медного (1)
и поляризуемого ртутного капельного (2) электродов
Концентрационная поляризация возникает, когда кинетическая поляризация незначительна, однако на ток существенно влияют стадии 1 и 3a, то есть лимитирующими стадиями процесса являются скорость передачи вещества из глубины раствора в приэлектродный слой или отвода из него продуктов. Если перенос вещества протекает путем диффузии, то говорят о диффузионной поляризации. Этот вид поляризации наблюдается только при высокой плотности тока на электроде. В отличие от кинетической поляризации при концентрационной поляризации ток не равен 0, а имеет определенное значение, которое не зависит от потенциала.
Таким образом, поляризованным следует считать электрод, для которого ток не зависит от потенциала.
 2014-02-13
2014-02-13 4910
4910
