1. Кислотно-основное титрование, определение рН раствора.
В этом случае индикаторный электрод должен реагировать на активность ионов Н+ (или величину рН раствора). К таким электродам относится, например, стеклянный электрод.
2. Окислительно-восстановительное титрование, определение потенциала раствора.
В этом случае в качестве индикаторных используют металлические инертные электроды. Они выполняют роль переносчиков электронов. Например, при титровании раствора Со2+ раствором K3[Fe(CN)6] протекает реакция:
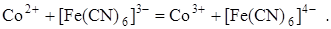
Индикаторным электродом является инертный платиновый электрод. Его потенциал до т. э. определяется наличием пары Co3+/Co2+, т. к. в растворе имеется ещё неоттитрованный Co2+ и образовавшийся продукт реакции – Co3+. Следовательно, уравнение Нернста для платинового электрода до т. э. запишется в виде
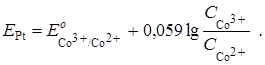
После т. э. в растворе образуется новая окислительно-восстановительная пара –  – за счёт наличия продукта реакции и появления избытка титранта. Теперь она определяет потенциал платинового электрода:
– за счёт наличия продукта реакции и появления избытка титранта. Теперь она определяет потенциал платинового электрода:
|
|
|
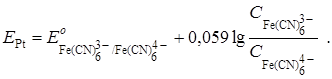
3. Осадительное титрование.
В этом случае в качестве индикаторных используют электроды, обратимые к определяемому иону или к титранту:
§ электроды I рода;
§ электроды II рода;
§ ИСЭ.
Например, для титрования ионов Cl– раствором AgNO3 можно взять серебряный электрод Ag/Ag+ (электрод I рода, реагирует на активность ионов титранта Ag+) или хлоридсеребряный электрод Ag, AgCl / KCl (электрод II рода, реагирует на активность определяемых ионов Cl–).
Кроме того, при проведении осадительного титрования можно воспользоваться инертным платиновым электродом, если искусственно создать в растворе окислительно-восстановительную пару. Например, при титровании раствора Zn2+ раствором K4[Fe(CN)6] протекает реакция осаждения:
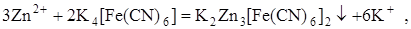
в ходе которой ни один элемент не меняет степени окисления, т. е. ни одной окислительно-восстановительной пары в растворе нет и платиновый электрод использовать невозможно. Но если добавить в раствор до начала титрования немного K3[Fe(CN)6], то в нём появляется пара 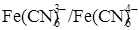 . При титровании концентрация одного из компонентов (K3[Fe(CN)6]) остаётся постоянной, а концентрация другого компонента (K4[Fe(CN)6]) меняется. Следовательно, меняется отношение их концентраций и потенциал платинового электрода тоже будет меняться.
. При титровании концентрация одного из компонентов (K3[Fe(CN)6]) остаётся постоянной, а концентрация другого компонента (K4[Fe(CN)6]) меняется. Следовательно, меняется отношение их концентраций и потенциал платинового электрода тоже будет меняться.
4. Комплексометрическое титрование.
В этом случае в качестве индикаторных используют электроды, обратимые к определяемому иону:
§ электроды I рода;
§ ИСЭ.
Кроме того, так же, как и при проведении осадительного титрования, можно воспользоваться инертным платиновым электродом, если искусственно создать в растворе окислительно-восстановительную пару. Например, при титровании ионов Fe3+ раствором комплексона III в раствор вводят немного Fe2+ и берут платиновый электрод.
|
|
|
 2014-02-13
2014-02-13 3959
3959
